+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | DdmD dimer apoprotein (CASP target) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | DdmD / helicase / nuclease / IMMUNE SYSTEM | |||||||||
| 機能・相同性 | Helicase/UvrB N-terminal domain-containing protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Streptococcus pyogenes (化膿レンサ球菌) / Streptococcus pyogenes (化膿レンサ球菌) /  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Bravo JPK / Taylor DW | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Plasmid targeting and destruction by the DdmDE bacterial defence system. 著者: Jack P K Bravo / Delisa A Ramos / Rodrigo Fregoso Ocampo / Caiden Ingram / David W Taylor /   要旨: Although eukaryotic Argonautes have a pivotal role in post-transcriptional gene regulation through nucleic acid cleavage, some short prokaryotic Argonaute variants (pAgos) rely on auxiliary nuclease ...Although eukaryotic Argonautes have a pivotal role in post-transcriptional gene regulation through nucleic acid cleavage, some short prokaryotic Argonaute variants (pAgos) rely on auxiliary nuclease factors for efficient foreign DNA degradation. Here we reveal the activation pathway of the DNA defence module DdmDE system, which rapidly eliminates small, multicopy plasmids from the Vibrio cholerae seventh pandemic strain (7PET). Through a combination of cryo-electron microscopy, biochemistry and in vivo plasmid clearance assays, we demonstrate that DdmE is a catalytically inactive, DNA-guided, DNA-targeting pAgo with a distinctive insertion domain. We observe that the helicase-nuclease DdmD transitions from an autoinhibited, dimeric complex to a monomeric state upon loading of single-stranded DNA targets. Furthermore, the complete structure of the DdmDE-guide-target handover complex provides a comprehensive view into how DNA recognition triggers processive plasmid destruction. Our work establishes a mechanistic foundation for how pAgos utilize ancillary factors to achieve plasmid clearance, and provides insights into anti-plasmid immunity in bacteria. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_44825.map.gz emd_44825.map.gz | 108.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-44825-v30.xml emd-44825-v30.xml emd-44825.xml emd-44825.xml | 16.6 KB 16.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_44825.png emd_44825.png | 71.9 KB | ||
| Filedesc metadata |  emd-44825.cif.gz emd-44825.cif.gz | 6.4 KB | ||
| その他 |  emd_44825_half_map_1.map.gz emd_44825_half_map_1.map.gz emd_44825_half_map_2.map.gz emd_44825_half_map_2.map.gz | 200.5 MB 200.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-44825 http://ftp.pdbj.org/pub/emdb/structures/EMD-44825 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44825 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44825 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_44825_validation.pdf.gz emd_44825_validation.pdf.gz | 877.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_44825_full_validation.pdf.gz emd_44825_full_validation.pdf.gz | 877.1 KB | 表示 | |
| XML形式データ |  emd_44825_validation.xml.gz emd_44825_validation.xml.gz | 15.6 KB | 表示 | |
| CIF形式データ |  emd_44825_validation.cif.gz emd_44825_validation.cif.gz | 18.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44825 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44825 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44825 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44825 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_44825.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_44825.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.94 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_44825_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
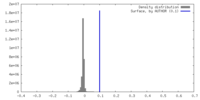
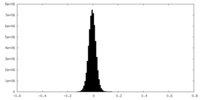
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_44825_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
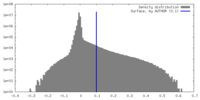
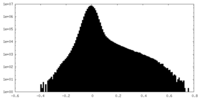
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : DdmD apo dimer
| 全体 | 名称: DdmD apo dimer |
|---|---|
| 要素 |
|
-超分子 #1: DdmD apo dimer
| 超分子 | 名称: DdmD apo dimer / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Streptococcus pyogenes (化膿レンサ球菌) Streptococcus pyogenes (化膿レンサ球菌) |
| 分子量 | 理論値: 211.54 KDa |
-分子 #1: Helicase/UvrB N-terminal domain-containing protein
| 分子 | 名称: Helicase/UvrB N-terminal domain-containing protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 136.145297 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MNVSIEEFTH FDFQLVPEPS PLDLVITESL KNHIEVNGVK SGALLPLPFQ TGIGKTYTAL NFLLQQMLEQ VRSELKEENT GKKSKRLLY YVTDSVDNVV SAKADLLKLI EKQTVKGEPR FTLEQQEYLK AQIVHLPNQS EQLLQCSDAV LNDVLIGFNL N AERDVQAE ...文字列: MNVSIEEFTH FDFQLVPEPS PLDLVITESL KNHIEVNGVK SGALLPLPFQ TGIGKTYTAL NFLLQQMLEQ VRSELKEENT GKKSKRLLY YVTDSVDNVV SAKADLLKLI EKQTVKGEPR FTLEQQEYLK AQIVHLPNQS EQLLQCSDAV LNDVLIGFNL N AERDVQAE WSAISGLRRH ASNPEVKISL NRQAGYFYRN LIDRLQKKQK GADRVLLSGS LLASVETLLP GEKIRNGSAH VA FLTTSKF LKGFHNTRSR YSPLRDLSGA VLIIDEIDKQ NQVILSELCK QQAQDLIWAI RTLRANFRDH QLESSPRYDK IED LFEPLR ERLEEFGTNW NLAFAFNTEG ANLNERPVRL FSDRSFTHVS SATHKLSLKS DFLRRKNLIF SDEKVEGSLI EKHG LLTRF VNEADVIYQW FLGTMRKAVF QYWENVRGLE IEVRENRSLE GTFQEAVQSL LTHFNLQEFE SAVYESFDTR GLRQS AGGK ANKLSSSKSY HHTGLKLVEV AHNQGTRDTV NCKASFLNTS PSGVLADMVD AGAVILGISA TARADTVIHN FDFKYL NER LGNKLLSLSR EQKQRVNNYY HSRRNYKDNG VVLTVKYLNS RDAFLDALLE EYKPEARSSH FILNHYLGIA ESEQAFV RS WLSKLLASIK AFISSPDNRY MLSLLNRTLD TTRQNINDFI QFCCDKWAKE FNVKTKTFFG VNADWMRLVG YDEISKHL N TELGKVVVFS TYASMGAGKN PDYAVNLALE GESLISVADV TYSTQLRSDI DSIYLEKPTQ LLLSDDYSHT ANQLCQFHQ ILSLQENGEL SPKSAENWCR QQLMGMSRER SLQQYHQTSD YQSAVRKYIE QAVGRAGRTS LKRKQILLFV DSGLKEILAE ESRDPSLFS HEYVALVNKA KSAGKSIVED RAVRRLFNLA QRNNKDGMLS IKALVHRLHN QPASKSDIQE WQDIRTQLLR Y PTVAFQPE RFNRLYLQSM TKGYYRYQGN LDGDPNSFEF FDRVPYGDMV SEEDCSLATL VQNQYVRPWF ERKGFACSWQ KE ANVMTPI MFTNIYKGAL GEQAVEAVLT AFDFTFEEVP NSIYERFDNR VIFAGIEQPI WLDSKYWKHE GNESSEGYSS KIA LVEEEF GPSKFIYVNA LGDTSKPIRY LNSCFVETSP QLAKVIEIPA LIDDSNADTN RTAVQELIKW LHHS UniProtKB: Helicase/UvrB N-terminal domain-containing protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)