+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
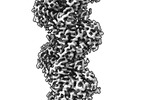
| タイトル | The structure of human cardiac F-actin | |||||||||
 マップデータ マップデータ | Final map used for model building. Post process and sharpening done in phenix using density modification scheme. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | actin / cardiac / human / sarcomere / CONTRACTILE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報actin filament-based movement / actin-myosin filament sliding / cardiac myofibril assembly / Formation of the dystrophin-glycoprotein complex (DGC) / cardiac muscle tissue morphogenesis / actomyosin structure organization / Striated Muscle Contraction / I band / RHOB GTPase cycle / microfilament motor activity ...actin filament-based movement / actin-myosin filament sliding / cardiac myofibril assembly / Formation of the dystrophin-glycoprotein complex (DGC) / cardiac muscle tissue morphogenesis / actomyosin structure organization / Striated Muscle Contraction / I band / RHOB GTPase cycle / microfilament motor activity / myosin binding / heart contraction / mesenchyme migration / skeletal muscle thin filament assembly / RHOA GTPase cycle / sarcomere / actin filament organization / filopodium / actin filament / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / lamellipodium / actin cytoskeleton / cell body / blood microparticle / hydrolase activity / focal adhesion / positive regulation of gene expression / negative regulation of apoptotic process / glutamatergic synapse / extracellular space / extracellular exosome / ATP binding / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Doran MH / Sousa D / Rynkiewicz MJ / Lehman W / Cammarato A | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: iScience / 年: 2025 ジャーナル: iScience / 年: 2025タイトル: The hypertrophic cardiomyopathy-associated A331P actin variant enhances basal contractile activity and elicits resting muscle dysfunction. 著者: Matthew H Doran / Michael J Rynkiewicz / Evan Despond / Meera C Viswanathan / Aditi Madan / Kripa Chitre / Axel J Fenwick / Duncan Sousa / William Lehman / John F Dawson / Anthony Cammarato /   要旨: Previous studies aimed at defining the mechanistic basis of hypertrophic cardiomyopathy caused by A331P cardiac actin have reported conflicting results. The mutation is located along an actin surface ...Previous studies aimed at defining the mechanistic basis of hypertrophic cardiomyopathy caused by A331P cardiac actin have reported conflicting results. The mutation is located along an actin surface strand, proximal to residues that interact with tropomyosin. These F-actin-tropomyosin associations are vital for proper contractile inhibition. To help resolve disease pathogenesis, we implemented a multidisciplinary approach. Transgenic , expressing A331P actin, displayed skeletal muscle hypercontraction and elevated basal myocardial activity. A331P thin filaments, reconstituted using recombinant human cardiac actin, exhibited higher myosin-based sliding speeds, exclusively at low Ca concentrations. Cryo-EM-based reconstructions revealed no detectable A331P-related structural perturbations in F-actin. , however, the P331-containing actin surface strand was less mobile and established diminished van der Waal's attractive forces with tropomyosin, which correlated with greater variability in inhibitory tropomyosin positioning. Such mutation-induced effects potentially elevate resting contractile activity among our models and may stimulate pathology in patients. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_44154.map.gz emd_44154.map.gz | 6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-44154-v30.xml emd-44154-v30.xml emd-44154.xml emd-44154.xml | 24.2 KB 24.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_44154.png emd_44154.png | 85.1 KB | ||
| Filedesc metadata |  emd-44154.cif.gz emd-44154.cif.gz | 6.7 KB | ||
| その他 |  emd_44154_additional_1.map.gz emd_44154_additional_1.map.gz emd_44154_additional_2.map.gz emd_44154_additional_2.map.gz emd_44154_half_map_1.map.gz emd_44154_half_map_1.map.gz emd_44154_half_map_2.map.gz emd_44154_half_map_2.map.gz | 78.3 MB 64.6 MB 65.2 MB 65.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-44154 http://ftp.pdbj.org/pub/emdb/structures/EMD-44154 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44154 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44154 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9b3rMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_44154.map.gz / 形式: CCP4 / 大きさ: 6.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_44154.map.gz / 形式: CCP4 / 大きさ: 6.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Final map used for model building. Post process and sharpening done in phenix using density modification scheme. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.058 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Post-processed map in RELION.
| ファイル | emd_44154_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Post-processed map in RELION. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Refinement from RELION without post-processing.
| ファイル | emd_44154_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Refinement from RELION without post-processing. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2.
| ファイル | emd_44154_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1.
| ファイル | emd_44154_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human cardiac F-actin
| 全体 | 名称: Human cardiac F-actin |
|---|---|
| 要素 |
|
-超分子 #1: Human cardiac F-actin
| 超分子 | 名称: Human cardiac F-actin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: ACTC was expressed in Sf21 insect cells, using recombinant baculoviruses, and purified via gelsolin affinity chromatography |
|---|---|
| 由来(天然) | 生物種:  株: Sf21 |
| 分子量 | 理論値: 420 KDa |
-分子 #1: Actin, alpha cardiac muscle 1
| 分子 | 名称: Actin, alpha cardiac muscle 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 42.07791 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MCDDEETTAL VCDNGSGLVK AGFAGDDAPR AVFPSIVGRP RHQGVMVGMG QKDSYVGDEA QSKRGILTLK YPIE(HIC)G IIT NWDDMEKIWH HTFYNELRVA PEEHPTLLTE APLNPKANRE KMTQIMFETF NVPAMYVAIQ AVLSLYASGR TTGIVLD SG ...文字列: MCDDEETTAL VCDNGSGLVK AGFAGDDAPR AVFPSIVGRP RHQGVMVGMG QKDSYVGDEA QSKRGILTLK YPIE(HIC)G IIT NWDDMEKIWH HTFYNELRVA PEEHPTLLTE APLNPKANRE KMTQIMFETF NVPAMYVAIQ AVLSLYASGR TTGIVLD SG DGVTHNVPIY EGYALPHAIM RLDLAGRDLT DYLMKILTER GYSFVTTAER EIVRDIKEKL CYVALDFENE MATAASSS S LEKSYELPDG QVITIGNERF RCPETLFQPS FIGMESAGIH ETTYNSIMKC DIDIRKDLYA NNVLSGGTTM YPGIADRMQ KEITALAPST MKIKIIAPPE RKYSVWIGGS ILASLSTFQQ MWISKQEYDE AGPSIVHRKC F UniProtKB: Actin, alpha cardiac muscle 1 |
-分子 #2: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 2 / コピー数: 3 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 3 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 8 詳細: 2 mmolL-1 Tris (pH 8), 0.2 mmolL-1 CaCl2, 0.2 mmolL-1 ATP, 0.5 mmolL-1 b-mercaptoethanol, 0.002% NaN3 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 8.0 µm / 最小 デフォーカス(公称値): 0.6 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 27.93 Å 想定した対称性 - らせんパラメータ - ΔΦ: -166.48 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) 解像度のタイプ: BY AUTHOR / 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 133289 |
|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION |
| 初期モデル | モデルのタイプ: OTHER / 詳細: Featureless cylinder |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
 ムービー
ムービー コントローラー
コントローラー








 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)