+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM Structure of Diffocin - precontracted - Trunk | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Phage tail-like / bacteriocin / trunk / pre-contraction / VIRUS LIKE PARTICLE | ||||||||||||
| 機能・相同性 | Phage tail tube protein / XkdM-like superfamily / Phage tail tube protein / Tail sheath protein, subtilisin-like domain / Phage tail sheath protein subtilisin-like domain / Tail sheath protein, C-terminal domain / Phage tail sheath C-terminal domain / Phage tail tube protein / Phage tail sheath protein 機能・相同性情報 機能・相同性情報 | ||||||||||||
| 生物種 |  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.2 Å | ||||||||||||
 データ登録者 データ登録者 | Cai XY / He Y / Zhou ZH | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Atomic structures of a bacteriocin targeting Gram-positive bacteria. 著者: Xiaoying Cai / Yao He / Iris Yu / Anthony Imani / Dean Scholl / Jeff F Miller / Z Hong Zhou /  要旨: Due to envelope differences between Gram-positive and Gram-negative bacteria, engineering precision bactericidal contractile nanomachines requires atomic-level understanding of their structures; ...Due to envelope differences between Gram-positive and Gram-negative bacteria, engineering precision bactericidal contractile nanomachines requires atomic-level understanding of their structures; however, only those killing Gram-negative bacteria are currently known. Here, we report the atomic structures of an engineered diffocin, a contractile syringe-like molecular machine that kills the Gram-positive bacterium Clostridioides difficile. Captured in one pre-contraction and two post-contraction states, each structure fashions six proteins in the bacteria-targeting baseplate, two proteins in the energy-storing trunk, and a collar linking the sheath with the membrane-penetrating tube. Compared to contractile machines targeting Gram-negative bacteria, major differences reside in the baseplate and contraction magnitude, consistent with target envelope differences. The multifunctional hub-hydrolase protein connects the tube and baseplate and is positioned to degrade peptidoglycan during penetration. The full-length tape measure protein forms a coiled-coil helix bundle homotrimer spanning the entire diffocin. Our study offers mechanical insights and principles for designing potent protein-based precision antibiotics. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42959.map.gz emd_42959.map.gz | 100.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42959-v30.xml emd-42959-v30.xml emd-42959.xml emd-42959.xml | 15 KB 15 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_42959.png emd_42959.png | 82.5 KB | ||
| マスクデータ |  emd_42959_msk_1.map emd_42959_msk_1.map | 512 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-42959.cif.gz emd-42959.cif.gz | 5.4 KB | ||
| その他 |  emd_42959_half_map_1.map.gz emd_42959_half_map_1.map.gz emd_42959_half_map_2.map.gz emd_42959_half_map_2.map.gz | 409.1 MB 409.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42959 http://ftp.pdbj.org/pub/emdb/structures/EMD-42959 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42959 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42959 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42959_validation.pdf.gz emd_42959_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42959_full_validation.pdf.gz emd_42959_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_42959_validation.xml.gz emd_42959_validation.xml.gz | 19 KB | 表示 | |
| CIF形式データ |  emd_42959_validation.cif.gz emd_42959_validation.cif.gz | 22.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42959 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42959 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42959 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42959 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8v3xMC  8v3tC  8v3wC  8v3yC  8v3zC  8v40C  8v41C  8v43C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42959.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42959.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.55 Å | ||||||||||||||||||||||||||||||||||||
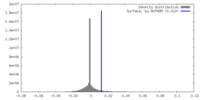
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_42959_msk_1.map emd_42959_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
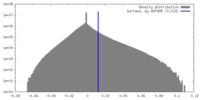
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_42959_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
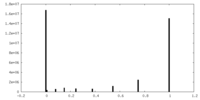
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_42959_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Diffocin
| 全体 | 名称: Diffocin |
|---|---|
| 要素 |
|
-超分子 #1: Diffocin
| 超分子 | 名称: Diffocin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) |
-分子 #1: Sheath (CD1363)
| 分子 | 名称: Sheath (CD1363) / タイプ: protein_or_peptide / ID: 1 / コピー数: 18 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) |
| 分子量 | 理論値: 39.26843 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAIGLPSINI SFKELATTVK ERSARGIIAM VLKDAKALGL NEIHEKEDIP VDLSAENKEY INLALMGNVN TPNKLLVYVI EGEADIQTA LDFLETKEFN YLCMPKAVEA DKTAIKNWII KLRDIDKVKV KAVLGKVVGN HEGIINFTTE DVLVGEKKYS V DEFTSRVA ...文字列: MAIGLPSINI SFKELATTVK ERSARGIIAM VLKDAKALGL NEIHEKEDIP VDLSAENKEY INLALMGNVN TPNKLLVYVI EGEADIQTA LDFLETKEFN YLCMPKAVEA DKTAIKNWII KLRDIDKVKV KAVLGKVVGN HEGIINFTTE DVLVGEKKYS V DEFTSRVA GLIAGTPLSQ SVTYTKLSDV VDIPKMTKVD AESRVNKGEL ILIKEAGAIR IARGVNSLTE LTAEKGEMFQ KI KIVDTLD IIHSDIRKVI IDDYIGKVTN SYDNKCLLIV AIKSYLEELE KSALIESDST VEIDFEAQKS YLKSKGVDLS YMT LQEIKE ANTGSKVFLK AKIKVLDAME DIDLSIEI UniProtKB: Phage tail sheath protein |
-分子 #2: Tube (CD1364)
| 分子 | 名称: Tube (CD1364) / タイプ: protein_or_peptide / ID: 2 / コピー数: 24 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Clostridioides difficile (バクテリア) Clostridioides difficile (バクテリア) |
| 分子量 | 理論値: 16.028353 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MANMEARNVM SGTWGELWLD GNKVAEVKKF QAKMEFTKED IIIAGQMGTD TKYMGYKGKG SITLYHVSSR MHKLIGEKIK RGSEPRFVA ISKLNDPDSY GAERIAVKNI AFDDLTLADW EVGVKGEIEA PFTFTEYDFL DII UniProtKB: Phage tail tube protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 450732 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)