+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Smooth Muscle Gamma Actin (ACTG2) Filament Mutant R40C | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Filament / Actin / Smooth Muscle / CYTOSOLIC PROTEIN / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Formation of the dystrophin-glycoprotein complex (DGC) / myosin filament / mesenchyme migration / Smooth Muscle Contraction / cell periphery / filopodium / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / actin cytoskeleton / lamellipodium / cell body ...Formation of the dystrophin-glycoprotein complex (DGC) / myosin filament / mesenchyme migration / Smooth Muscle Contraction / cell periphery / filopodium / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / actin cytoskeleton / lamellipodium / cell body / blood microparticle / hydrolase activity / positive regulation of gene expression / extracellular space / extracellular exosome / ATP binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
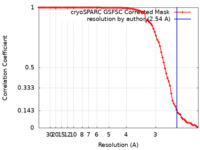
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.54 Å | |||||||||
 データ登録者 データ登録者 | Palmer NJ / Carman PJ / Ceron RH / Dominguez R | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2024 ジャーナル: Sci Adv / 年: 2024タイトル: Molecular mechanisms linking missense ACTG2 mutations to visceral myopathy. 著者: Rachel H Ceron / Faviolla A Báez-Cruz / Nicholas J Palmer / Peter J Carman / Malgorzata Boczkowska / Robert O Heuckeroth / E Michael Ostap / Roberto Dominguez /  要旨: Visceral myopathy is a life-threatening disease characterized by muscle weakness in the bowel, bladder, and uterus. Mutations in smooth muscle γ-actin (ACTG2) are the most common cause of the ...Visceral myopathy is a life-threatening disease characterized by muscle weakness in the bowel, bladder, and uterus. Mutations in smooth muscle γ-actin (ACTG2) are the most common cause of the disease, but the mechanisms by which the mutations alter muscle function are unknown. Here, we examined four prevalent ACTG2 mutations (R40C, R148C, R178C, and R257C) that cause different disease severity and are spread throughout the actin fold. R178C displayed premature degradation, R148C disrupted interactions with actin-binding proteins, R40C inhibited polymerization, and R257C destabilized filaments. Because these mutations are heterozygous, we also analyzed 50/50 mixtures with wild-type (WT) ACTG2. The WT/R40C mixture impaired filament nucleation by leiomodin 1, and WT/R257C produced filaments that were easily fragmented by smooth muscle myosin. Smooth muscle tropomyosin isoform Tpm1.4 partially rescued the defects of R40C and R257C. Cryo-electron microscopy structures of filaments formed by R40C and R257C revealed disrupted intersubunit contacts. The biochemical and structural properties of the mutants correlate with their genotype-specific disease severity. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42939.map.gz emd_42939.map.gz | 32.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42939-v30.xml emd-42939-v30.xml emd-42939.xml emd-42939.xml | 19.7 KB 19.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_42939_fsc.xml emd_42939_fsc.xml | 8.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_42939.png emd_42939.png | 52.4 KB | ||
| マスクデータ |  emd_42939_msk_1.map emd_42939_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-42939.cif.gz emd-42939.cif.gz | 6.9 KB | ||
| その他 |  emd_42939_half_map_1.map.gz emd_42939_half_map_1.map.gz emd_42939_half_map_2.map.gz emd_42939_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42939 http://ftp.pdbj.org/pub/emdb/structures/EMD-42939 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42939 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42939 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42939_validation.pdf.gz emd_42939_validation.pdf.gz | 838.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42939_full_validation.pdf.gz emd_42939_full_validation.pdf.gz | 837.8 KB | 表示 | |
| XML形式データ |  emd_42939_validation.xml.gz emd_42939_validation.xml.gz | 16 KB | 表示 | |
| CIF形式データ |  emd_42939_validation.cif.gz emd_42939_validation.cif.gz | 21 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42939 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42939 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42939 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42939 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42939.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42939.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_42939_msk_1.map emd_42939_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_42939_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_42939_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : ACTG2 R40C Filament
| 全体 | 名称: ACTG2 R40C Filament |
|---|---|
| 要素 |
|
-超分子 #1: ACTG2 R40C Filament
| 超分子 | 名称: ACTG2 R40C Filament / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: ACTG2 filaments, purified from Expi293 cells R40C mutation |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Smooth Muscle Homo sapiens (ヒト) / 組織: Smooth Muscle |
-分子 #1: Actin, gamma-enteric smooth muscle
| 分子 | 名称: Actin, gamma-enteric smooth muscle / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 組織: Smooth Muscle Homo sapiens (ヒト) / 組織: Smooth Muscle |
| 分子量 | 理論値: 41.881766 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MCEEETTALV CDNGSGLCKA GFAGDDAPRA VFPSIVGRPC HQGVMVGMGQ KDSYVGDEAQ SKRGILTLKY PIE(HIC)GI ITN WDDMEKIWHH SFYNELRVAP EEHPTLLTEA PLNPKANREK MTQIMFETFN VPAMYVAIQA VLSLYASGRT TGIVLDS GD ...文字列: MCEEETTALV CDNGSGLCKA GFAGDDAPRA VFPSIVGRPC HQGVMVGMGQ KDSYVGDEAQ SKRGILTLKY PIE(HIC)GI ITN WDDMEKIWHH SFYNELRVAP EEHPTLLTEA PLNPKANREK MTQIMFETFN VPAMYVAIQA VLSLYASGRT TGIVLDS GD GVTHNVPIYE GYALPHAIMR LDLAGRDLTD YLMKILTERG YSFVTTAERE IVRDIKEKLC YVALDFENEM ATAASSSS L EKSYELPDGQ VITIGNERFR CPETLFQPSF IGMESAGIHE TTYNSIMKCD IDIRKDLYAN NVLSGGTTMY PGIADRMQK EITALAPSTM KIKIIAPPER KYSVWIGGSI LASLSTFQQM WISKPEYDEA GPSIVHRKCF UniProtKB: Actin, gamma-enteric smooth muscle |
-分子 #2: Phalloidin
| 分子 | 名称: Phalloidin / タイプ: protein_or_peptide / ID: 2 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 808.899 Da |
| 配列 | 文字列: W(EEP)A(DTH)C(HYP)A |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 5 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 5 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.168 mg/mL | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: Actin F-buffer | ||||||||||||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 12 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 120 sec. / 前処理 - 雰囲気: AIR | ||||||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK III / 詳細: Blot Force: 0 Blot Time: 2.5 s. | ||||||||||||||||||||||||
| 詳細 | ACTG2 F-actin in the ADP state. R40C mutation |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 4461 / 平均電子線量: 45.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)