+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | NorA double mutant - E222QD307N at pH 7.5 | ||||||||||||||||||||||||||||||
 マップデータ マップデータ | |||||||||||||||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||||||||||||||
 キーワード キーワード | E222QD307N NorA / efflux pump / MRSA / TRANSPORT PROTEIN / TRANSPORT PROTEIN-IMMUNE SYSTEM complex | ||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | ||||||||||||||||||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||||||||||||||
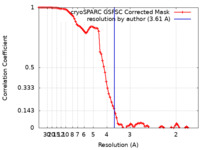
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.61 Å | ||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Li JP / Li Y / Koide A / Kuang HH / Torres VJ / Koide S / Wang DN / Traaseth NJ | ||||||||||||||||||||||||||||||
| 資金援助 |  米国, 9件 米国, 9件
| ||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Proton-coupled transport mechanism of the efflux pump NorA. 著者: Jianping Li / Yan Li / Akiko Koide / Huihui Kuang / Victor J Torres / Shohei Koide / Da-Neng Wang / Nathaniel J Traaseth /  要旨: Efflux pump antiporters confer drug resistance to bacteria by coupling proton import with the expulsion of antibiotics from the cytoplasm. Despite efforts there remains a lack of understanding as to ...Efflux pump antiporters confer drug resistance to bacteria by coupling proton import with the expulsion of antibiotics from the cytoplasm. Despite efforts there remains a lack of understanding as to how acid/base chemistry drives drug efflux. Here, we uncover the proton-coupling mechanism of the Staphylococcus aureus efflux pump NorA by elucidating structures in various protonation states of two essential acidic residues using cryo-EM. Protonation of Glu222 and Asp307 within the C-terminal domain stabilized the inward-occluded conformation by forming hydrogen bonds between the acidic residues and a single helix within the N-terminal domain responsible for occluding the substrate binding pocket. Remarkably, deprotonation of both Glu222 and Asp307 is needed to release interdomain tethering interactions, leading to opening of the pocket for antibiotic entry. Hence, the two acidic residues serve as a "belt and suspenders" protection mechanism to prevent simultaneous binding of protons and drug that enforce NorA coupling stoichiometry and confer antibiotic resistance. | ||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41606.map.gz emd_41606.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41606-v30.xml emd-41606-v30.xml emd-41606.xml emd-41606.xml | 24.7 KB 24.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_41606_fsc.xml emd_41606_fsc.xml | 8.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_41606.png emd_41606.png | 54.8 KB | ||
| マスクデータ |  emd_41606_msk_1.map emd_41606_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-41606.cif.gz emd-41606.cif.gz | 7.1 KB | ||
| その他 |  emd_41606_half_map_1.map.gz emd_41606_half_map_1.map.gz emd_41606_half_map_2.map.gz emd_41606_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41606 http://ftp.pdbj.org/pub/emdb/structures/EMD-41606 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41606 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41606 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_41606_validation.pdf.gz emd_41606_validation.pdf.gz | 778.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_41606_full_validation.pdf.gz emd_41606_full_validation.pdf.gz | 777.7 KB | 表示 | |
| XML形式データ |  emd_41606_validation.xml.gz emd_41606_validation.xml.gz | 16.4 KB | 表示 | |
| CIF形式データ |  emd_41606_validation.cif.gz emd_41606_validation.cif.gz | 21.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41606 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41606 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41606 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41606 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41606.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41606.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.844 Å | ||||||||||||||||||||||||||||||||||||
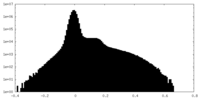
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_41606_msk_1.map emd_41606_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
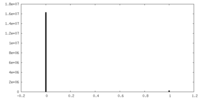
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_41606_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
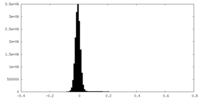
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_41606_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
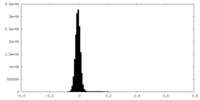
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : E222QD307N-NorA:FabDA1
| 全体 | 名称: E222QD307N-NorA:FabDA1 |
|---|---|
| 要素 |
|
-超分子 #1: E222QD307N-NorA:FabDA1
| 超分子 | 名称: E222QD307N-NorA:FabDA1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 100.655 KDa |
-分子 #1: Quinolone resistance protein NorA
| 分子 | 名称: Quinolone resistance protein NorA / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 46.653879 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MNKQIFVLYF NIFLIFLGIG LVIPVLPVYL KDLGLTGSDL GLLVAAFALS QMIISPFGGT LADKLGKKLI ICIGLILFSV SEFMFAVGH NFSVLMLSRV IGGMSAGMVM PGVTGLIADI SPSHQKAKNF GYMSAIINSG FILGPGIGGF MAEVSHRMPF Y FAGALGIL ...文字列: MNKQIFVLYF NIFLIFLGIG LVIPVLPVYL KDLGLTGSDL GLLVAAFALS QMIISPFGGT LADKLGKKLI ICIGLILFSV SEFMFAVGH NFSVLMLSRV IGGMSAGMVM PGVTGLIADI SPSHQKAKNF GYMSAIINSG FILGPGIGGF MAEVSHRMPF Y FAGALGIL AFIMSIVLIH DPKKSTTSGF QKLEPQLLTK INWKVFITPV ILTLVLSFGL SAFQTLYSLY TADKVNYSPK DI SIAITGG GIFGALFQIY FFDKFMKYFS ELTFIAWSLL YSVVVLILLV FANDYWSIML ISFVVFIGFN MIRPAITNYF SNI AGERQG FAGGLNSTFT SMGNFIGPLI AGALFDVHIE APIYMAIGVS LAGVVIVLIE KQHRAKLKEQ NMENLYFQGK LGPE QKLIS EEDLNSAVDH HHHHHHHHH UniProtKB: Quinolone resistance protein NorA |
-分子 #2: Heavy Chain of FabDA1 Variable Domain
| 分子 | 名称: Heavy Chain of FabDA1 Variable Domain / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 14.070568 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: EVQLVESGGG LVQPGGSLRL SCAASGFTFS SSSIHWVRQA PGKGLEWVAS ISSSSGSTSY ADSVKGRFTI SADTSKNTAY LQMNSLRAE DTAVYYCARM SVENHWYYFY WYMSPYAMDY WGQGTLVTV |
-分子 #3: Light Chain of FabDA1 Variable Domain
| 分子 | 名称: Light Chain of FabDA1 Variable Domain / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.209451 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: IQMTQSPSSL SASVGDRVTI TCRASQSVSS AVAWYQQKPG KAPKLLIYSA SSLYSGVPSR FSGSRSGTDF TLTISSLQPE DFATYYCQQ SSSSLITFGQ GTKVEI |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 77.0 K / 最高: 77.0 K |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 平均露光時間: 1.2 sec. / 平均電子線量: 50.25 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: OTHER |
|---|---|
| 得られたモデル |  PDB-8ttf: |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)