+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
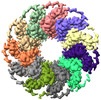
| タイトル | Cryo-EM structure of human full-length RAD52 | |||||||||
 マップデータ マップデータ | Sharpened map used for modeling | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | DNA repair / RECOMBINATION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報double-strand break repair via single-strand annealing / DNA double-strand break processing involved in repair via single-strand annealing / DNA recombinase assembly / mitotic recombination / HDR through MMEJ (alt-NHEJ) / regulation of nucleotide-excision repair / HDR through Single Strand Annealing (SSA) / SUMOylation of DNA damage response and repair proteins / double-strand break repair via homologous recombination / protein-DNA complex ...double-strand break repair via single-strand annealing / DNA double-strand break processing involved in repair via single-strand annealing / DNA recombinase assembly / mitotic recombination / HDR through MMEJ (alt-NHEJ) / regulation of nucleotide-excision repair / HDR through Single Strand Annealing (SSA) / SUMOylation of DNA damage response and repair proteins / double-strand break repair via homologous recombination / protein-DNA complex / double-strand break repair / single-stranded DNA binding / cellular response to oxidative stress / DNA recombination / protein-containing complex / DNA binding / nucleoplasm / identical protein binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.5 Å | |||||||||
 データ登録者 データ登録者 | Schnicker NJ / Razzaghi M / Spies M | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2025 ジャーナル: Nature / 年: 2025タイトル: The RAD52 double-ring remodels replication forks restricting fork reversal. 著者: Masayoshi Honda / Mortezaali Razzaghi / Paras Gaur / Eva Malacaria / Giorgia Marozzi / Ludovica Di Biagi / Francesca Antonella Aiello / Emeleeta A Paintsil / Andrew J Stanfield / Bailey J ...著者: Masayoshi Honda / Mortezaali Razzaghi / Paras Gaur / Eva Malacaria / Giorgia Marozzi / Ludovica Di Biagi / Francesca Antonella Aiello / Emeleeta A Paintsil / Andrew J Stanfield / Bailey J Deppe / Lokesh Gakhar / Nicholas J Schnicker / M Ashley Spies / Pietro Pichierri / Maria Spies /   要旨: Human RAD52 is a multifunctional DNA repair protein involved in several cellular events that support genome stability, including protection of stalled DNA replication forks from excessive degradation. ...Human RAD52 is a multifunctional DNA repair protein involved in several cellular events that support genome stability, including protection of stalled DNA replication forks from excessive degradation. In its gatekeeper role, RAD52 binds to and stabilizes stalled replication forks during replication stress, protecting them from reversal by SMARCAL1 motor. The structural and molecular mechanism of the RAD52-mediated fork protection remains elusive. Here, using P1 nuclease sensitivity, biochemical and single-molecule analyses, we show that RAD52 dynamically remodels replication forks through its strand exchange activity. The presence of the single-stranded DNA binding protein RPA at the fork modulates the kinetics of the strand exchange without impeding the reaction outcome. Mass photometry and single-particle cryo-electron microscopy show that the replication fork promotes a unique nucleoprotein structure containing head-to-head arrangement of two undecameric RAD52 rings with an extended positively charged surface that accommodates all three arms of the replication fork. We propose that the formation and continuity of this surface is important for the strand exchange reaction and for competition with SMARCAL1. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41357.map.gz emd_41357.map.gz | 91.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41357-v30.xml emd-41357-v30.xml emd-41357.xml emd-41357.xml | 21.9 KB 21.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_41357_fsc.xml emd_41357_fsc.xml | 9.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_41357.png emd_41357.png | 202.4 KB | ||
| Filedesc metadata |  emd-41357.cif.gz emd-41357.cif.gz | 6.8 KB | ||
| その他 |  emd_41357_half_map_1.map.gz emd_41357_half_map_1.map.gz emd_41357_half_map_2.map.gz emd_41357_half_map_2.map.gz | 95.5 MB 95.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41357 http://ftp.pdbj.org/pub/emdb/structures/EMD-41357 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41357 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41357 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_41357_validation.pdf.gz emd_41357_validation.pdf.gz | 671.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_41357_full_validation.pdf.gz emd_41357_full_validation.pdf.gz | 671 KB | 表示 | |
| XML形式データ |  emd_41357_validation.xml.gz emd_41357_validation.xml.gz | 18.1 KB | 表示 | |
| CIF形式データ |  emd_41357_validation.cif.gz emd_41357_validation.cif.gz | 23.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41357 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41357 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41357 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41357 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41357.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41357.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map used for modeling | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8255 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map 2
| ファイル | emd_41357_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
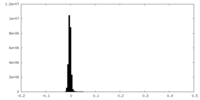
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1
| ファイル | emd_41357_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
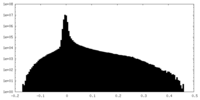
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human RAD52 undecameric structure
| 全体 | 名称: Human RAD52 undecameric structure |
|---|---|
| 要素 |
|
-超分子 #1: Human RAD52 undecameric structure
| 超分子 | 名称: Human RAD52 undecameric structure / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 532 KDa |
-分子 #1: DNA repair protein RAD52 homolog
| 分子 | 名称: DNA repair protein RAD52 homolog / タイプ: protein_or_peptide / ID: 1 / コピー数: 11 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 48.40402 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGSSHHHHHH SSGLVPRGSH MSGTEEAILG GRDSHPAAGG GSVLCFGQCQ YTAEEYQAIQ KALRQRLGPE YISSRMAGGG QKVCYIEGH RVINLANEMF GYNGWAHSIT QQNVDFVDLN NGKFYVGVCA FVRVQLKDGS YHEDVGYGVS EGLKSKALSL E KARKEAVT ...文字列: MGSSHHHHHH SSGLVPRGSH MSGTEEAILG GRDSHPAAGG GSVLCFGQCQ YTAEEYQAIQ KALRQRLGPE YISSRMAGGG QKVCYIEGH RVINLANEMF GYNGWAHSIT QQNVDFVDLN NGKFYVGVCA FVRVQLKDGS YHEDVGYGVS EGLKSKALSL E KARKEAVT DGLKRALRSF GNALGNCILD KDYLRSLNKL PRQLPLEVDL TKAKRQDLEP SVEEARYNSC RPNMALGHPQ LQ QVTSPSR PSHAVIPADQ DCSSRSLSSS AVESEATHQR KLRQKQLQQQ FRERMEKQQV RVSTPSAEKS EAAPPAPPVT HST PVTVSE PLLEKDFLAG VTQELIKTLE DNSEKWAVTP DAGDGVVKPS SRADPAQTSD TLALNNQMVT QNRTPHSVCH QKPQ AKSGS WDLQTYSADQ RTTGNWESHR KSQDMKKRKY DPS UniProtKB: DNA repair protein RAD52 homolog |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.25 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 9 構成要素:
詳細: 20 mM Tris pH 9, 200 mM KCl, 1 mM DTT | ||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR / 詳細: -15 mA | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV | ||||||||||||
| 詳細 | Sample was made from frozen protein |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 詳細 | No tilt data and tilted data (30 deg) was collected at the same time and processed together |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 2 / 実像数: 11288 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 詳細 | Initial fitting was done in Chimera followed by refinement with Namdinator and then PHENIX alone |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 130.2 当てはまり具合の基準: Cross-correlation coefficient |
| 得られたモデル |  PDB-8tkq: |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)