+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3989 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Morphology V - cross-beta amyloid fibril structure from the IGSNVVTWYQQL peptide of AL immunoglobulin light chain by cryo-EM | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
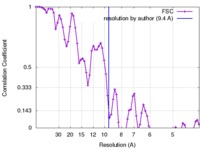
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 9.4 Å | |||||||||
 データ登録者 データ登録者 | Close W / Faendrich M | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2018 ジャーナル: Nat Commun / 年: 2018タイトル: Physical basis of amyloid fibril polymorphism. 著者: William Close / Matthias Neumann / Andreas Schmidt / Manuel Hora / Karthikeyan Annamalai / Matthias Schmidt / Bernd Reif / Volker Schmidt / Nikolaus Grigorieff / Marcus Fändrich /   要旨: Polymorphism is a key feature of amyloid fibril structures but it remains challenging to explain these variations for a particular sample. Here, we report electron cryomicroscopy-based ...Polymorphism is a key feature of amyloid fibril structures but it remains challenging to explain these variations for a particular sample. Here, we report electron cryomicroscopy-based reconstructions from different fibril morphologies formed by a peptide fragment from an amyloidogenic immunoglobulin light chain. The observed fibril morphologies vary in the number and cross-sectional arrangement of a structurally conserved building block. A comparison with the theoretically possible constellations reveals the experimentally observed spectrum of fibril morphologies to be governed by opposing sets of forces that primarily arise from the β-sheet twist, as well as peptide-peptide interactions within the fibril cross-section. Our results provide a framework for rationalizing and predicting the structure and polymorphism of cross-β fibrils, and suggest that a small number of physical parameters control the observed fibril architectures. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3989.map.gz emd_3989.map.gz | 48.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3989-v30.xml emd-3989-v30.xml emd-3989.xml emd-3989.xml | 10.2 KB 10.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_3989_fsc.xml emd_3989_fsc.xml | 7.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_3989.png emd_3989.png | 51.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3989 http://ftp.pdbj.org/pub/emdb/structures/EMD-3989 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3989 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3989 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3989_validation.pdf.gz emd_3989_validation.pdf.gz | 220.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3989_full_validation.pdf.gz emd_3989_full_validation.pdf.gz | 219.7 KB | 表示 | |
| XML形式データ |  emd_3989_validation.xml.gz emd_3989_validation.xml.gz | 8.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3989 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3989 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3989 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3989 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3989.map.gz / 形式: CCP4 / 大きさ: 54.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3989.map.gz / 形式: CCP4 / 大きさ: 54.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Amyloidogenic Fragment IGSNVVTWYQQL of Immunoglobulin Light Chain...
| 全体 | 名称: Amyloidogenic Fragment IGSNVVTWYQQL of Immunoglobulin Light Chain of a Human AL Patient |
|---|---|
| 要素 |
|
-超分子 #1: Amyloidogenic Fragment IGSNVVTWYQQL of Immunoglobulin Light Chain...
| 超分子 | 名称: Amyloidogenic Fragment IGSNVVTWYQQL of Immunoglobulin Light Chain of a Human AL Patient タイプ: complex / ID: 1 / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種: synthetic construct (人工物) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 5.00 mg/mL |
|---|---|
| 緩衝液 | pH: 8 / 構成要素 - 濃度: 50.0 mM / 構成要素 - 名称: Tris |
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 50 % / 装置: GATAN CRYOPLUNGE 3 詳細: Incubation of fibril solution on glow discharged holey carbon grid for 30 seconds and backside blotting for 4 seconds before plunging. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - サイズ - 横: 7420 pixel / デジタル化 - サイズ - 縦: 7676 pixel / デジタル化 - 画像ごとのフレーム数: 1-73 / 実像数: 458 / 平均露光時間: 21.9 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)