| 登録情報 | データベース: EMDB / ID: EMD-38437
|
|---|
| タイトル | Structure of human propionyl-CoA carboxylase in complex with acetyl-CoA (PCC-ACO) |
|---|
 マップデータ マップデータ | |
|---|
 試料 試料 | - 複合体: Heterododecamer complex of human propionyl-CoA carboxylase in complex with acetyl-CoA (PCC-ACO)
- タンパク質・ペプチド: Propionyl-CoA carboxylase alpha chain, mitochondrial
- タンパク質・ペプチド: Propionyl-CoA carboxylase beta chain, mitochondrial
- リガンド: BIOTIN
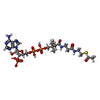
- リガンド: ACETYL COENZYME *A
|
|---|
 キーワード キーワード | Biotin-dependent carboxylase / LIGASE |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
short-chain fatty acid catabolic process / branched-chain amino acid metabolic process / Propionyl-CoA catabolism / propionyl-CoA carboxylase / propionyl-CoA carboxylase activity / Defective HLCS causes multiple carboxylase deficiency / Biotin transport and metabolism / biotin binding / catalytic complex / Mitochondrial protein degradation ...short-chain fatty acid catabolic process / branched-chain amino acid metabolic process / Propionyl-CoA catabolism / propionyl-CoA carboxylase / propionyl-CoA carboxylase activity / Defective HLCS causes multiple carboxylase deficiency / Biotin transport and metabolism / biotin binding / catalytic complex / Mitochondrial protein degradation / fatty acid metabolic process / mitochondrial matrix / enzyme binding / mitochondrion / ATP binding / metal ion binding / cytosol類似検索 - 分子機能 Propionyl-coenzyme A carboxylase, BT domain / Propionyl-coenzyme A carboxylase BT domain / : / : / Acetyl-coenzyme A carboxyltransferase, C-terminal / Acetyl-coenzyme A (CoA) carboxyltransferase C-terminal domain profile. / Acetyl-coenzyme A carboxyltransferase, N-terminal / Acetyl-coenzyme A (CoA) carboxyltransferase N-terminal domain profile. / Acetyl-CoA carboxylase / Carboxyl transferase domain ...Propionyl-coenzyme A carboxylase, BT domain / Propionyl-coenzyme A carboxylase BT domain / : / : / Acetyl-coenzyme A carboxyltransferase, C-terminal / Acetyl-coenzyme A (CoA) carboxyltransferase C-terminal domain profile. / Acetyl-coenzyme A carboxyltransferase, N-terminal / Acetyl-coenzyme A (CoA) carboxyltransferase N-terminal domain profile. / Acetyl-CoA carboxylase / Carboxyl transferase domain / Biotin-binding site / Biotin-requiring enzymes attachment site. / Biotin carboxylase-like, N-terminal domain / Biotin carboxylase, C-terminal / Biotin carboxylation domain / Biotin carboxylase, N-terminal domain / Biotin carboxylase C-terminal domain / Biotin carboxylation domain profile. / Biotin carboxylase C-terminal domain / Carbamoyl-phosphate synthase subdomain signature 1. / Carbamoyl-phosphate synthetase large subunit-like, ATP-binding domain / Carbamoyl-phosphate synthase L chain, ATP binding domain / Biotin-requiring enzyme / Rudiment single hybrid motif / Biotinyl/lipoyl domain profile. / Biotin/lipoyl attachment / Single hybrid motif / ATP-grasp fold, subdomain 1 / Pre-ATP-grasp domain superfamily / ATP-grasp fold / ATP-grasp fold profile. / ClpP/crotonase-like domain superfamily / Carbamoyl-phosphate synthase subdomain signature 2.類似検索 - ドメイン・相同性 Propionyl-CoA carboxylase alpha chain, mitochondrial / Propionyl-CoA carboxylase beta chain, mitochondrial類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.38 Å |
|---|
 データ登録者 データ登録者 | Zhou FY / Zhang YY / Zhou Q / Hu Q |
|---|
| 資金援助 | 1件 | Organization | Grant number | 国 |
|---|
| Not funded | | |
|
|---|
 引用 引用 |  ジャーナル: Elife / 年: 2024 ジャーナル: Elife / 年: 2024
タイトル: Structural insights into human propionyl-CoA carboxylase (PCC) and 3-methylcrotonyl-CoA carboxylase (MCC)
著者: Zhou F / Zhang Y / Zhu Y / Zhou Q / Shi Y / Hu Q |
|---|
| 履歴 | | 登録 | 2023年12月25日 | - |
|---|
| ヘッダ(付随情報) 公開 | 2024年10月30日 | - |
|---|
| マップ公開 | 2024年10月30日 | - |
|---|
| 更新 | 2024年11月20日 | - |
|---|
| 現状 | 2024年11月20日 | 処理サイト: PDBj / 状態: 公開 |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 引用
引用 ジャーナル: Elife / 年: 2024
ジャーナル: Elife / 年: 2024 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_38437.map.gz
emd_38437.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-38437-v30.xml
emd-38437-v30.xml emd-38437.xml
emd-38437.xml EMDBヘッダ
EMDBヘッダ emd_38437.png
emd_38437.png emd-38437.cif.gz
emd-38437.cif.gz emd_38437_half_map_1.map.gz
emd_38437_half_map_1.map.gz emd_38437_half_map_2.map.gz
emd_38437_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-38437
http://ftp.pdbj.org/pub/emdb/structures/EMD-38437 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38437
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38437 emd_38437_validation.pdf.gz
emd_38437_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_38437_full_validation.pdf.gz
emd_38437_full_validation.pdf.gz emd_38437_validation.xml.gz
emd_38437_validation.xml.gz emd_38437_validation.cif.gz
emd_38437_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38437
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38437 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38437
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-38437 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_38437.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_38437.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)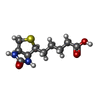
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析 ムービー
ムービー コントローラー
コントローラー



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




































