[English] 日本語
 Yorodumi
Yorodumi- EMDB-37514: Cryo-EM structure of ClassIII Lanthipeptide modification enzyme P... -
+ Open data
Open data
- Basic information
Basic information
| Entry |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Cryo-EM structure of ClassIII Lanthipeptide modification enzyme PneKC in the presence of PneA and GTPrS. | |||||||||
 Map data Map data | ||||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | Lanthibiotic / RiPPs / LanKC / CryoEM / Antimicrobial peptides / Antiviral peptides. / ANTIMICROBIAL PROTEIN | |||||||||
| Function / homology |  Function and homology information Function and homology information | |||||||||
| Biological species |  | |||||||||
| Method | single particle reconstruction / Resolution: 3.7 Å | |||||||||
 Authors Authors | Li Y / Luo M / Shao K / Li J | |||||||||
| Funding support |  Singapore, 1 items Singapore, 1 items
| |||||||||
 Citation Citation |  Journal: Nat Commun / Year: 2024 Journal: Nat Commun / Year: 2024Title: Mechanistic insights into lanthipeptide modification by a distinct subclass of LanKC enzyme that forms dimers. Authors: Yifan Li / Kai Shao / Zhaoxing Li / Kongfu Zhu / Bee Koon Gan / Jian Shi / Yibei Xiao / Min Luo /   Abstract: Naturally occurring lanthipeptides, peptides post-translationally modified by various enzymes, hold significant promise as antibiotics. Despite extensive biochemical and structural studies, the ...Naturally occurring lanthipeptides, peptides post-translationally modified by various enzymes, hold significant promise as antibiotics. Despite extensive biochemical and structural studies, the events preceding peptide modification remain poorly understood. Here, we identify a distinct subclass of lanthionine synthetase KC (LanKC) enzymes with distinct structural and functional characteristics. We show that PneKC, a member of this subclass, forms a dimer and possesses GTPase activity. Through three cryo-EM structures of PneKC, we illustrate different stages of peptide PneA binding, from initial recognition to full binding. Our structures show the kinase domain complexed with the PneA core peptide and GTPγS, a phosphate-bound lyase domain, and an unconventional cyclase domain. The leader peptide of PneA interact with a gate loop, transitioning from an extended to a helical conformation. We identify a dimerization hot spot and propose a "negative cooperativity" mechanism toggling the enzyme between tense and relaxed conformation. Additionally, we identify an important salt bridge in the cyclase domain, differing from those in in conventional cyclase domains. These residues are highly conserved in the LanKC subclass and are part of two signature motifs. These results unveil potential differences in lanthipeptide modification enzymes assembly and deepen our understanding of allostery in these multifunctional enzymes. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Supplemental images |
|---|
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_37514.map.gz emd_37514.map.gz | 59.7 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-37514-v30.xml emd-37514-v30.xml emd-37514.xml emd-37514.xml | 20.5 KB 20.5 KB | Display Display |  EMDB header EMDB header |
| FSC (resolution estimation) |  emd_37514_fsc.xml emd_37514_fsc.xml | 8.5 KB | Display |  FSC data file FSC data file |
| Images |  emd_37514.png emd_37514.png | 47 KB | ||
| Filedesc metadata |  emd-37514.cif.gz emd-37514.cif.gz | 6.7 KB | ||
| Others |  emd_37514_half_map_1.map.gz emd_37514_half_map_1.map.gz emd_37514_half_map_2.map.gz emd_37514_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37514 http://ftp.pdbj.org/pub/emdb/structures/EMD-37514 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37514 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37514 | HTTPS FTP |
-Related structure data
| Related structure data |  8wgoMC  8w7aC  8w7jC M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- Map
Map
| File |  Download / File: emd_37514.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_37514.map.gz / Format: CCP4 / Size: 64 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & slices | Image control
Images are generated by Spider. | ||||||||||||||||||||||||||||||||||||
| Voxel size | X=Y=Z: 0.858 Å | ||||||||||||||||||||||||||||||||||||
| Density |
| ||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
|
-Supplemental data
-Half map: #2
| File | emd_37514_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
-Half map: #1
| File | emd_37514_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Projections & Slices |
| ||||||||||||
| Density Histograms |
- Sample components
Sample components
-Entire : Dimeric structure of Class III lanthipeptide modification PneKC w...
| Entire | Name: Dimeric structure of Class III lanthipeptide modification PneKC with GSP and PneA bound to one protomer. |
|---|---|
| Components |
|
-Supramolecule #1: Dimeric structure of Class III lanthipeptide modification PneKC w...
| Supramolecule | Name: Dimeric structure of Class III lanthipeptide modification PneKC with GSP and PneA bound to one protomer. type: complex / ID: 1 / Parent: 0 / Macromolecule list: #1 |
|---|---|
| Source (natural) | Organism:  |
| Molecular weight | Theoretical: 210 KDa |
-Macromolecule #1: Protein kinase domain-containing protein
| Macromolecule | Name: Protein kinase domain-containing protein / type: protein_or_peptide / ID: 1 / Number of copies: 2 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  |
| Molecular weight | Theoretical: 100.581195 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: MDYNFNLEHP FFFTNNDYST DTSIKYQASL PFNWHEVMNN DEWVYQYPIG KFVERQGWKI HISSEYNSSH ELLQDVAKIC HEMRIPFKH LSTEDKFIMR NGKLVSRGFS GKFITCYPNQ NELESVLQRL ESALKQYNGP YILSDKRWDE APIYLRYGVF R PSRDDEKK ...String: MDYNFNLEHP FFFTNNDYST DTSIKYQASL PFNWHEVMNN DEWVYQYPIG KFVERQGWKI HISSEYNSSH ELLQDVAKIC HEMRIPFKH LSTEDKFIMR NGKLVSRGFS GKFITCYPNQ NELESVLQRL ESALKQYNGP YILSDKRWDE APIYLRYGVF R PSRDDEKK VAIDELIVGD EVVKDERLPV FKIPKGIVPP DFLNKWLDKK DKKQGDFPFI IDNAIRFSNS GGIYNARLKE DG KKIILKE ARPYTGLGFD GTYSSEKLAS ECKALKILNE WSEAPKIYWH GKIWEHTFLG IEHMKGVPLN RWVTNNFPLY EVV DKTKDY LLRVSKIVEK LIDLTNKFHS ENVYHQDLHL GNILVKDEDE ISIIDWEQAV FSNDEKVVHK VAAPGFRAWR ETLP SEIDW YGIRQIAHYL YMPLVTTSDL TYNYVSQTRI EGKKLFESLG YTREHIDYVE SLLSYLDSKC PQIENISRKK VLKPM HEIR TIESEQDIQD FIIKLLRGFT LTYGQWRKEF QSRFFPVHYY GLNFNQGIAF SDLAILWSYQ QLAKKVKNFK FDDYYE IRT QVINEAVNNF KKSSLSGLFD GKIGTIWLIY EFGEIDRAVE LFTTHFIEIF ENSQNKNLYS GQAGILLVGL YFLSKGE ID NKLGEEILIR LREYTLNYIE NPETFCKVGA SDVQSNDPYE NFGGLLYGHA GVAWLFGEAY KLTGESIYKN GLELAVDK E LVAYKVDSNN SLQYSQGHRL LPYLATGSAG LLLLINRNKE ILSSKYLKYL TSLERATDVV FCVLPGLFNG FCGLEVANN IYSDIDDNFS GQKKLIEQLY RYLCVIEEGF VIAGDNGLKI TTDIASGFAG VAIGLVSIMD NKLTILPQI UniProtKB: Protein kinase domain-containing protein |
-Macromolecule #2: SapB/AmfS family lantipeptide
| Macromolecule | Name: SapB/AmfS family lantipeptide / type: protein_or_peptide / ID: 2 / Number of copies: 1 / Enantiomer: LEVO |
|---|---|
| Source (natural) | Organism:  |
| Molecular weight | Theoretical: 4.880407 KDa |
| Recombinant expression | Organism:  |
| Sequence | String: FQGMAEEVLN LQLVSVQVDE TDEVDGMRFS TFSTNRCGN(UNK) (UNK)(UNK)(UNK)(UNK)(UNK) |
-Macromolecule #3: MAGNESIUM ION
| Macromolecule | Name: MAGNESIUM ION / type: ligand / ID: 3 / Number of copies: 1 / Formula: MG |
|---|---|
| Molecular weight | Theoretical: 24.305 Da |
-Macromolecule #4: 5'-GUANOSINE-DIPHOSPHATE-MONOTHIOPHOSPHATE
| Macromolecule | Name: 5'-GUANOSINE-DIPHOSPHATE-MONOTHIOPHOSPHATE / type: ligand / ID: 4 / Number of copies: 1 / Formula: GSP |
|---|---|
| Molecular weight | Theoretical: 539.246 Da |
| Chemical component information | 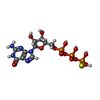 ChemComp-GSP: |
-Macromolecule #5: PHOSPHATE ION
| Macromolecule | Name: PHOSPHATE ION / type: ligand / ID: 5 / Number of copies: 2 / Formula: PO4 |
|---|---|
| Molecular weight | Theoretical: 94.971 Da |
| Chemical component information |  ChemComp-PO4: |
-Macromolecule #6: water
| Macromolecule | Name: water / type: ligand / ID: 6 / Number of copies: 1 / Formula: HOH |
|---|---|
| Molecular weight | Theoretical: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-Experimental details
-Structure determination
 Processing Processing | single particle reconstruction |
|---|---|
| Aggregation state | particle |
- Sample preparation
Sample preparation
| Buffer | pH: 7.4 Component:
|
|---|
- Electron microscopy
Electron microscopy
| Microscope | FEI TITAN KRIOS |
|---|---|
| Image recording | Film or detector model: GATAN K3 (6k x 4k) / Average electron dose: 32.0 e/Å2 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Illumination mode: SPOT SCAN / Imaging mode: BRIGHT FIELD / Nominal defocus max: 2.0 µm / Nominal defocus min: 1.0 µm |
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
 Movie
Movie Controller
Controller





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





































