+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM map of Myosin VI in the autoinhibited state (with SAH-extension density) | |||||||||
 マップデータ マップデータ | cryo-EM map of autoinhibited MyoVI with SAH-extension | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | myosin VI / autoinhibition / intracellular transport / MOTOR PROTEIN | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.14 Å | |||||||||
 データ登録者 データ登録者 | Niu F / Wei Z | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Autoinhibition and activation of myosin VI revealed by its cryo-EM structure. 著者: Fengfeng Niu / Lingxuan Li / Lei Wang / Jinman Xiao / Shun Xu / Yong Liu / Leishu Lin / Cong Yu / Zhiyi Wei /  要旨: Myosin VI is the only molecular motor that moves towards the minus end along actin filaments. Numerous cellular processes require myosin VI and tight regulations of the motor's activity. Defects in ...Myosin VI is the only molecular motor that moves towards the minus end along actin filaments. Numerous cellular processes require myosin VI and tight regulations of the motor's activity. Defects in myosin VI activity are known to cause genetic diseases such as deafness and cardiomyopathy. However, the molecular mechanisms underlying the activity regulation of myosin VI remain elusive. Here, we determined the high-resolution cryo-electron microscopic structure of myosin VI in its autoinhibited state. Our structure reveals that autoinhibited myosin VI adopts a compact, monomeric conformation via extensive interactions between the head and tail domains, orchestrated by an elongated single-α-helix region resembling a "spine". This autoinhibited structure effectively blocks cargo binding sites and represses the motor's ATPase activity. Certain cargo adaptors such as GIPC can release multiple inhibitory interactions and promote motor activity, pointing to a cargo-mediated activation of the processive motor. Moreover, our structural findings allow rationalization of disease-associated mutations in myosin VI. Beyond the activity regulation mechanisms of myosin VI, our study also sheds lights on how activities of other myosin motors such as myosin VII and X might be regulated. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37261.map.gz emd_37261.map.gz | 284.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37261-v30.xml emd-37261-v30.xml emd-37261.xml emd-37261.xml | 18.1 KB 18.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_37261.png emd_37261.png | 71.4 KB | ||
| Filedesc metadata |  emd-37261.cif.gz emd-37261.cif.gz | 5.8 KB | ||
| その他 |  emd_37261_half_map_1.map.gz emd_37261_half_map_1.map.gz emd_37261_half_map_2.map.gz emd_37261_half_map_2.map.gz | 301.2 MB 301.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37261 http://ftp.pdbj.org/pub/emdb/structures/EMD-37261 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37261 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37261 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37261_validation.pdf.gz emd_37261_validation.pdf.gz | 990 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37261_full_validation.pdf.gz emd_37261_full_validation.pdf.gz | 989.6 KB | 表示 | |
| XML形式データ |  emd_37261_validation.xml.gz emd_37261_validation.xml.gz | 16.9 KB | 表示 | |
| CIF形式データ |  emd_37261_validation.cif.gz emd_37261_validation.cif.gz | 20 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37261 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37261 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37261 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37261 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37261.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37261.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | cryo-EM map of autoinhibited MyoVI with SAH-extension | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.827 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: half map B
| ファイル | emd_37261_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half_map_B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
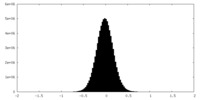
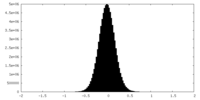
| 密度ヒストグラム |
-ハーフマップ: half map A
| ファイル | emd_37261_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half_map_A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
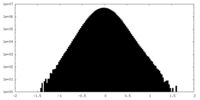
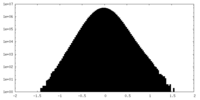
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of Myosin VI and Calmodulin
| 全体 | 名称: Complex of Myosin VI and Calmodulin |
|---|---|
| 要素 |
|
-超分子 #1: Complex of Myosin VI and Calmodulin
| 超分子 | 名称: Complex of Myosin VI and Calmodulin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|
-超分子 #2: Myosin VI
| 超分子 | 名称: Myosin VI / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #3: Calmodulin
| 超分子 | 名称: Calmodulin / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Myosin VI
| 分子 | 名称: Myosin VI / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MEDGKPVWAP HPTDGFQMGN IVDIGPDSLT IEPLNQKGKT FLALINQVFP AEEDSKKDVE DNCSLMYLNE ATLLHNIKVR YSKDRIYTYV ANILIAVNPY FDIPKIYSSE AIKSYQGKSL GTRPPHVFAI ADKAFRDMKV LKMSQSIIVS GESGAGKTEN TKFVLRYLTE ...文字列: MEDGKPVWAP HPTDGFQMGN IVDIGPDSLT IEPLNQKGKT FLALINQVFP AEEDSKKDVE DNCSLMYLNE ATLLHNIKVR YSKDRIYTYV ANILIAVNPY FDIPKIYSSE AIKSYQGKSL GTRPPHVFAI ADKAFRDMKV LKMSQSIIVS GESGAGKTEN TKFVLRYLTE SYGTGQDIDD RIVEANPLLE AFGNAKTVRN NNSSRFGKFV EIHFNEKSSV VGGFVSHYLL EKSRICVQGK EERNYHIFYR LCAGASEDIR EKLHLSSPDN FRYLNRGCTR YFANKETDKQ ILQNRKSPEY LKAGSMKDPL LDDHGDFIRM CTAMKKIGLD DEEKLDLFRV VAGVLHLGNI DFEEAGSTSG GCNLKNKSAQ SLEYCAELLG LDQDDLRVSL TTRVMLTTAG GTKGTVIKVP LKVEQANNAR DALAKTVYSH LFDHVVNRVN QCFPFETSSY FIGVLDIAGF EYFEHNSFEQ FCINYCNEKL QQFFNERILK EEQELYQKEG LGVNEVHYVD NQDCIDLIEA KLVGILDILD EENRLPQPSD QHFTSAVHQK HKDHFRLTIP RKSKLAVHRN IRDDEGFIIR HFAGAVCYET TQFVEKNNDA LHMSLESLIC ESRDKFIREL FESSTNNNKD TKQKAGKLSF ISVGNKFKTQ LNLLLDKLRS TGASFIRCIK PNLKMTSHHF EGAQILSQLQ CSGMVSVLDL MQGGYPSRAS FHELYNMYKK YMPDKLARLD PRLFCKALFK ALGLNENDYK FGLTKVFFRP GKFAEFDQIM KSDPDHLAEL VKRVNHWLTC SRWKKVQWCS LSVIKLKNKI KYRAEACIKM QKTIRMWLCK RRHKPRIDGL VKVGTLKKRL DKFNEVVSVL KDGKPEMNKQ IKNLEISIDT LMAKIKSTMM TQEQIQKEYD ALVKSSEELL SALQKKKQQE EEAERLRRIQ EEMEKERKRR EEDEKRRRKE EEERRMKLEM EAKRKQEEEE RKKREDDEKR IQAEVEAQLA RQKEEESQQQ AVLEQERRDR ELALRIAQSE AELISDEAQA DLALRRNDGT RPKMTPEQMA KEMSEFLSRG PAVLATKAAA GTKKYDLSKW KYAELRDTIN TSCDIELLAA CREEFHRRLK VYHAWKSKNK KRNTETEQRA PKSVTDYDFA PFLNNSPQQN PAAQIPARQR EIEMNRQQRF FRIPFIRPAD QYKDPQSKKK GWWYAHFDGP WIARQMELHP DKPPILLVAG KDDMEMCELN LEETGLTRKR GAEILPRQFE EIWERCGGIQ YLQNAIESRQ ARPTYATAML QSLLK |
-分子 #2: Calmodulin
| 分子 | 名称: Calmodulin / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MADQLTEEQI AEFKEAFSLF DKDGDGTITT KELGTVMRSL GQNPTEAELQ DMINEVDADG NGTIDFPEFL TMMARKMKDT DSEEEIREAF RVFDKDGNGY ISAAELRHVM TNLGEKLTDE EVDEMIREAD IDGDGQVNYE EFVQMMTAK |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均露光時間: 2.0 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)