+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
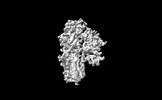
| タイトル | Cryo-EM structure of ATP13A2 in the E1-like state | |||||||||
 マップデータ マップデータ | Cryo-EM structure of ATP13A2 in the E1-like state | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Cryo-EM structure of ATP13A2 in the E1-like state / membrane protein / PROTEIN TRANSPORT | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報polyamine transmembrane transporter activity / polyamine transmembrane transport / spermine transmembrane transport / : / ABC-type polyamine transporter activity / regulation of autophagosome size / extracellular exosome biogenesis / regulation of chaperone-mediated autophagy / negative regulation of lysosomal protein catabolic process / regulation of autophagy of mitochondrion ...polyamine transmembrane transporter activity / polyamine transmembrane transport / spermine transmembrane transport / : / ABC-type polyamine transporter activity / regulation of autophagosome size / extracellular exosome biogenesis / regulation of chaperone-mediated autophagy / negative regulation of lysosomal protein catabolic process / regulation of autophagy of mitochondrion / P-type ion transporter activity / regulation of lysosomal protein catabolic process / intracellular monoatomic cation homeostasis / autophagosome-lysosome fusion / autophagosome organization / protein localization to lysosome / phosphatidic acid binding / positive regulation of exosomal secretion / multivesicular body membrane / ATPase-coupled monoatomic cation transmembrane transporter activity / regulation of protein localization to nucleus / intracellular zinc ion homeostasis / cupric ion binding / regulation of mitochondrion organization / phosphatidylinositol-3,5-bisphosphate binding / トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う / lysosomal transport / regulation of intracellular protein transport / lipid homeostasis / cellular response to zinc ion / Ion transport by P-type ATPases / regulation of neuron apoptotic process / autophagosome membrane / regulation of macroautophagy / transport vesicle / cellular response to manganese ion / multivesicular body / lysosomal lumen / autophagosome / positive regulation of protein secretion / autophagy / intracellular calcium ion homeostasis / late endosome membrane / late endosome / manganese ion binding / cellular response to oxidative stress / vesicle / monoatomic ion transmembrane transport / intracellular iron ion homeostasis / neuron projection / lysosome / lysosomal membrane / neuronal cell body / positive regulation of gene expression / ATP hydrolysis activity / zinc ion binding / ATP binding / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.65 Å | |||||||||
 データ登録者 データ登録者 | Liu ZM / Mu JQ / Xue CY | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Conformational cycle of human polyamine transporter ATP13A2. 著者: Jianqiang Mu / Chenyang Xue / Lei Fu / Zongjun Yu / Minhan Nie / Mengqi Wu / Xinmeng Chen / Kun Liu / Ruiqian Bu / Ying Huang / Baisheng Yang / Jianming Han / Qianru Jiang / Kevin C Chan / ...著者: Jianqiang Mu / Chenyang Xue / Lei Fu / Zongjun Yu / Minhan Nie / Mengqi Wu / Xinmeng Chen / Kun Liu / Ruiqian Bu / Ying Huang / Baisheng Yang / Jianming Han / Qianru Jiang / Kevin C Chan / Ruhong Zhou / Huilin Li / Ancheng Huang / Yong Wang / Zhongmin Liu /  要旨: Dysregulation of polyamine homeostasis strongly associates with human diseases. ATP13A2, which is mutated in juvenile-onset Parkinson's disease and autosomal recessive spastic paraplegia 78, is a ...Dysregulation of polyamine homeostasis strongly associates with human diseases. ATP13A2, which is mutated in juvenile-onset Parkinson's disease and autosomal recessive spastic paraplegia 78, is a transporter with a critical role in balancing the polyamine concentration between the lysosome and the cytosol. Here, to better understand human ATP13A2-mediated polyamine transport, we use single-particle cryo-electron microscopy to solve high-resolution structures of human ATP13A2 in six intermediate states, including the putative E2 structure for the P5 subfamily of the P-type ATPases. These structures comprise a nearly complete conformational cycle spanning the polyamine transport process and capture multiple substrate binding sites distributed along the transmembrane regions, suggesting a potential polyamine transport pathway. Integration of high-resolution structures, biochemical assays, and molecular dynamics simulations allows us to obtain a better understanding of the structural basis of how hATP13A2 transports polyamines, providing a mechanistic framework for ATP13A2-related diseases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_35385.map.gz emd_35385.map.gz | 96.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-35385-v30.xml emd-35385-v30.xml emd-35385.xml emd-35385.xml | 14.9 KB 14.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_35385.png emd_35385.png | 26.7 KB | ||
| Filedesc metadata |  emd-35385.cif.gz emd-35385.cif.gz | 5.9 KB | ||
| その他 |  emd_35385_half_map_1.map.gz emd_35385_half_map_1.map.gz emd_35385_half_map_2.map.gz emd_35385_half_map_2.map.gz | 95.4 MB 95.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-35385 http://ftp.pdbj.org/pub/emdb/structures/EMD-35385 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-35385 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-35385 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_35385_validation.pdf.gz emd_35385_validation.pdf.gz | 791.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_35385_full_validation.pdf.gz emd_35385_full_validation.pdf.gz | 791.1 KB | 表示 | |
| XML形式データ |  emd_35385_validation.xml.gz emd_35385_validation.xml.gz | 13.1 KB | 表示 | |
| CIF形式データ |  emd_35385_validation.cif.gz emd_35385_validation.cif.gz | 15.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-35385 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-35385 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-35385 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-35385 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8ielMC  8iekC  8iemC  8ienC  8ieoC  8ierC  8iesC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_35385.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_35385.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM structure of ATP13A2 in the E1-like state | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.095 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: The half a map of ATP13A2 in the E1-like state
| ファイル | emd_35385_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | The half_a map of ATP13A2 in the E1-like state | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: The half map of ATP13A2 in the E1-like state
| ファイル | emd_35385_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | The half_ map of ATP13A2 in the E1-like state | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Cryo-EM structure of ATP13A2 in the E1-like state
| 全体 | 名称: Cryo-EM structure of ATP13A2 in the E1-like state |
|---|---|
| 要素 |
|
-超分子 #1: Cryo-EM structure of ATP13A2 in the E1-like state
| 超分子 | 名称: Cryo-EM structure of ATP13A2 in the E1-like state / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Polyamine-transporting ATPase 13A2
| 分子 | 名称: Polyamine-transporting ATPase 13A2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO EC番号: トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 124.090664 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: RLSGYCGSPW RVIGYHVVVW MMAGIPLLLF RWKPLWGVRL RLRPCNLAHA ETLVIEIRDK EDSSWQLFTV QVQTEAVSVG QLEPSPQSQ AEDGRSQAAV GAVPEGAWKD TAQLHKSEEA KRVLRYYLFQ GQRYIWIETQ QAFYQVSLLD HGRSCDDVHR S RHGLSLQD ...文字列: RLSGYCGSPW RVIGYHVVVW MMAGIPLLLF RWKPLWGVRL RLRPCNLAHA ETLVIEIRDK EDSSWQLFTV QVQTEAVSVG QLEPSPQSQ AEDGRSQAAV GAVPEGAWKD TAQLHKSEEA KRVLRYYLFQ GQRYIWIETQ QAFYQVSLLD HGRSCDDVHR S RHGLSLQD QMVRKAIYGP NVISIPVKSY PQLLVDEALN PYYGFQAFSI ALWLADHYYW YALCIFLISS ISICLSLYKT RK QSQTLRD MVKLSMRVCV CRPGGEEEWV DSSELVPGDC LVLPQEGGLM PCDAALVAGE CMVNESSLTG ESIPVLKTAL PEG LGPYCA ETHRRHTLFC GTLILQARAY VGPHVLAVVT RTGFCTAKGG LVSSILHPRP INFKFYKHSM KFVAALSVLA LLGT IYSIF ILYRNRVPLN EIVIRALDLV TVVVPPALPA AMTVCTLYAQ SRLRRQGIFC IHPLRINLGG KLQLVCFDKT GTLTE DGLD VMGVVPLKGQ AFLPLVPEPR RLPVGPLLRA LATCHALSRL QDTPVGDPMD LKMVESTGWV LEEEPAADSA FGTQVL AVM RPPLWEPQLQ AMEEPPVPVS VLHRFPFSSA LQRMSVVVAW PGATQPEAYV KGSPELVAGL CNPETVPTDF AQMLQSY TA AGYRVVALAS KPLPTVPSLE AAQQLTRDTV EGDLSLLGLL VMRNLLKPQT TPVIQALRRT RIRAVMVTGD NLQTAVTV A RGCGMVAPQE HLIIVHATHP ERGQPASLEF LPMESPTAVN GVKDPDQAAS YTVEPDPRSR HLALSGPTFG IIVKHFPKL LPKVLVQGTV FARMAPEQKT ELVCELQKLQ YCVGMCGDGA NDCGALKAAD VGISLSQAEA SVVSPFTSSM ASIECVPMVI REGRCSLDT SFSVFKYMAL YSLTQFISVL ILYTINTNLG DLQFLAIDLV ITTTVAVLMS RTGPALVLGR VRPPGALLSV P VLSSLLLQ MVLVTGVQLG GYFLTLAQPW FVPLNRTVAA PDNLPNYENT VVFSLSSFQY LILAAAVSKG APFRRPLYTN VP FLVALAL LSSVLVGLVL VPGLLQGPLA LRNITDTGFK LLLLGLVTLN FVGAFMLESV LDQCLPACLR RLRPKRASKK RFK QLEREL AEQR UniProtKB: Polyamine-transporting ATPase 13A2 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 5.65 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 242367 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)