+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 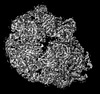 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
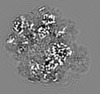
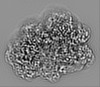
| タイトル | Designed pH-responsive P22 VLP | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | P22 coat protein / designed protein / VIRUS LIKE PARTICLE | |||||||||
| 機能・相同性 | Major capsid protein Gp5 / P22 coat protein - gene protein 5 / viral procapsid / viral procapsid maturation / T=7 icosahedral viral capsid / viral capsid / identical protein binding / Major capsid protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Lederbergvirus (ウイルス) Lederbergvirus (ウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.02 Å | |||||||||
 データ登録者 データ登録者 | Kim KJ / Kim G / Bae JH / Song JJ / Kim HS | |||||||||
| 資金援助 |  韓国, 1件 韓国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Adv Healthc Mater / 年: 2024 ジャーナル: Adv Healthc Mater / 年: 2024タイトル: A pH-Responsive Virus-Like Particle as a Protein Cage for a Targeted Delivery. 著者: Kwan-Jip Kim / Gijeong Kim / Jin-Ho Bae / Ji-Joon Song / Hak-Sung Kim /  要旨: A stimuli-responsive protein self-assembly offers promising utility as a protein nanocage for biotechnological and medical applications. Herein, the development of a virus-like particle (VLP) that ...A stimuli-responsive protein self-assembly offers promising utility as a protein nanocage for biotechnological and medical applications. Herein, the development of a virus-like particle (VLP) that undergoes a transition between assembly and disassembly under a neutral and acidic pH, respectively, for a targeted delivery is reported. The structure of the bacteriophage P22 coat protein is used for the computational design of coat subunits that self-assemble into a pH-responsive VLP. Subunit designs are generated through iterative computational cycles of histidine substitutions and evaluation of the interaction energies among the subunits under an acidic and neutral pH. The top subunit designs are tested and one that is assembled into a VLP showing the highest pH-dependent structural transition is selected. The cryo-EM structure of the VLP is determined, and the structural basis of a pH-triggered disassembly is delineated. The utility of the designed VLP is exemplified through the targeted delivery of a cytotoxic protein cargo into tumor cells in a pH-dependent manner. These results provide strategies for the development of self-assembling protein architectures with new functionality for diverse applications. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
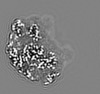
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34155.map.gz emd_34155.map.gz | 11.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34155-v30.xml emd-34155-v30.xml emd-34155.xml emd-34155.xml | 16.5 KB 16.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_34155.png emd_34155.png | 108 KB | ||
| Filedesc metadata |  emd-34155.cif.gz emd-34155.cif.gz | 5.8 KB | ||
| その他 |  emd_34155_half_map_1.map.gz emd_34155_half_map_1.map.gz emd_34155_half_map_2.map.gz emd_34155_half_map_2.map.gz | 11.7 MB 11.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34155 http://ftp.pdbj.org/pub/emdb/structures/EMD-34155 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34155 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34155 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_34155_validation.pdf.gz emd_34155_validation.pdf.gz | 846.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_34155_full_validation.pdf.gz emd_34155_full_validation.pdf.gz | 846.2 KB | 表示 | |
| XML形式データ |  emd_34155_validation.xml.gz emd_34155_validation.xml.gz | 7.3 KB | 表示 | |
| CIF形式データ |  emd_34155_validation.cif.gz emd_34155_validation.cif.gz | 9.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34155 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34155 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34155 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34155 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8gn5MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34155.map.gz / 形式: CCP4 / 大きさ: 12.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34155.map.gz / 形式: CCP4 / 大きさ: 12.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
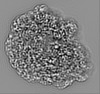
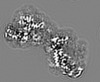
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.2995 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_34155_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
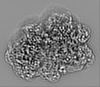
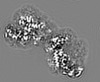
| 投影像・断面図 |
| ||||||||||||
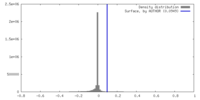
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_34155_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
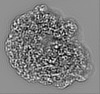
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Lederbergvirus
| 全体 | 名称:  Lederbergvirus (ウイルス) Lederbergvirus (ウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Lederbergvirus
| 超分子 | 名称: Lederbergvirus / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: all / NCBI-ID: 186794 / 生物種: Lederbergvirus / ウイルスタイプ: VIRUS-LIKE PARTICLE / ウイルス・単離状態: OTHER / ウイルス・エンベロープ: Yes / ウイルス・中空状態: Yes |
|---|---|
| 宿主 | 生物種:  Lederbergvirus (ウイルス) Lederbergvirus (ウイルス) |
-分子 #1: Major capsid protein
| 分子 | 名称: Major capsid protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Lederbergvirus (ウイルス) Lederbergvirus (ウイルス) |
| 分子量 | 理論値: 46.40118 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: NEGQIVTLAV DEIIETISAI TPMAQKAKKY TPPAASMQRH SNTIWMPVEQ HSPTQEGWDL TDKATGLLEL NVAVNMGEPD NDFFQLRAD DLRDETAYRR RIQSAARKLA NNVELKVANM AAEMGSLVIT SPDAIGTNTA DAWNFVADAE HIMFSRELNR D MGTSYFFN ...文字列: NEGQIVTLAV DEIIETISAI TPMAQKAKKY TPPAASMQRH SNTIWMPVEQ HSPTQEGWDL TDKATGLLEL NVAVNMGEPD NDFFQLRAD DLRDETAYRR RIQSAARKLA NNVELKVANM AAEMGSLVIT SPDAIGTNTA DAWNFVADAE HIMFSRELNR D MGTSYFFN PQDYKKAGYD LTKRDIFGRI PEEAYRDGTI QRQVAGFDDV LRSPKLPVLT KSTATGITVS GAQSFKPVAW QL DNDGNKV NVDNRFATVT LSATTGMKRG DKISFAGVKF LGQMAKHVLA QDATFSVVRV VDGTHVEITP KPVALDDVSL SPE QRAYAN VNTSLADAMA VNILNVKDAR TNVFWADDAI RIVSQPIPAN HELFAGMKTT SFSIPDVGLN GIFATQGDIS TLSG LCRIA LWYGVNATRP EAIGVGLPGQ UniProtKB: Major capsid protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 17 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
詳細: PBS buffer pH 7.4 | |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 詳細: The grid was glow discharged at 15 mA for 1 min. | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 288 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 1654 / 平均露光時間: 52.69 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: OTHER / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 92000 |
 ムービー
ムービー コントローラー
コントローラー





 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)