+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
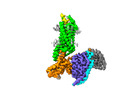
| タイトル | Complex structure of Neuropeptide Y Y2 receptor in complex with NPY and Gi | |||||||||
 マップデータ マップデータ | Composite map | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of nervous system process / regulation of nerve growth factor production / peptide YY receptor activity / short-day photoperiodism / negative regulation of acute inflammatory response to antigenic stimulus / positive regulation of circadian sleep/wake cycle, non-REM sleep / positive regulation of peptide secretion / neuropeptide Y receptor activity / monocyte activation / positive regulation of dopamine metabolic process ...negative regulation of nervous system process / regulation of nerve growth factor production / peptide YY receptor activity / short-day photoperiodism / negative regulation of acute inflammatory response to antigenic stimulus / positive regulation of circadian sleep/wake cycle, non-REM sleep / positive regulation of peptide secretion / neuropeptide Y receptor activity / monocyte activation / positive regulation of dopamine metabolic process / positive regulation of nitric oxide metabolic process / positive regulation of appetite / neuropeptide Y receptor binding / intestinal epithelial cell differentiation / synaptic signaling via neuropeptide / positive regulation of eating behavior / negative regulation of secretion / cardiac left ventricle morphogenesis / adult feeding behavior / positive regulation of smooth muscle contraction / positive regulation of dopamine secretion / regulation of presynaptic cytosolic calcium ion concentration / negative regulation of excitatory postsynaptic potential / neuropeptide hormone activity / feeding behavior / negative regulation of synaptic transmission, glutamatergic / non-motile cilium / negative regulation of cAMP/PKA signal transduction / positive regulation of cell-substrate adhesion / negative regulation of feeding behavior / regulation of synaptic vesicle exocytosis / central nervous system neuron development / outflow tract morphogenesis / nitric oxide mediated signal transduction / G protein-coupled receptor signaling pathway, coupled to cyclic nucleotide second messenger / neuropeptide signaling pathway / behavioral fear response / FOXO-mediated transcription of oxidative stress, metabolic and neuronal genes / neuronal dense core vesicle / adenylate cyclase inhibitor activity / positive regulation of protein localization to cell cortex / T cell migration / Adenylate cyclase inhibitory pathway / negative regulation of blood pressure / D2 dopamine receptor binding / response to prostaglandin E / adenylate cyclase regulator activity / G protein-coupled serotonin receptor binding / adenylate cyclase-inhibiting serotonin receptor signaling pathway / cellular response to forskolin / regulation of mitotic spindle organization / Peptide ligand-binding receptors / calcium channel regulator activity / Regulation of insulin secretion / locomotory behavior / positive regulation of cholesterol biosynthetic process / negative regulation of insulin secretion / G protein-coupled receptor activity / G protein-coupled receptor binding / response to peptide hormone / adenylate cyclase-inhibiting G protein-coupled receptor signaling pathway / GABA-ergic synapse / cerebral cortex development / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / centriolar satellite / G-protein beta/gamma-subunit complex binding / Olfactory Signaling Pathway / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / G protein-coupled acetylcholine receptor signaling pathway / terminal bouton / G-protein activation / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / G beta:gamma signalling through CDC42 / Glucagon signaling in metabolic regulation / neuron projection development / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / ADP signalling through P2Y purinoceptor 12 / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / Glucagon-type ligand receptors / Adrenaline,noradrenaline inhibits insulin secretion / Vasopressin regulates renal water homeostasis via Aquaporins / GDP binding / G alpha (z) signalling events / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADP signalling through P2Y purinoceptor 1 / cellular response to catecholamine stimulus / ADORA2B mediated anti-inflammatory cytokines production / G beta:gamma signalling through PI3Kgamma / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / adenylate cyclase-activating dopamine receptor signaling pathway / GPER1 signaling / Inactivation, recovery and regulation of the phototransduction cascade / cellular response to prostaglandin E stimulus 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.11 Å | |||||||||
 データ登録者 データ登録者 | Kang H / Park C / Kim J / Choi H-J | |||||||||
| 資金援助 |  韓国, 2件 韓国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2023 ジャーナル: Structure / 年: 2023タイトル: Structural basis for Y2 receptor-mediated neuropeptide Y and peptide YY signaling. 著者: Hyunook Kang / Chaehee Park / Yeol Kyo Choi / Jungnam Bae / Sohee Kwon / Jinuk Kim / Chulwon Choi / Chaok Seok / Wonpil Im / Hee-Jung Choi /   要旨: Neuropeptide Y (NPY) and its receptors are expressed in various human tissues including the brain where they regulate appetite and emotion. Upon NPY stimulation, the neuropeptide Y1 and Y2 receptors ...Neuropeptide Y (NPY) and its receptors are expressed in various human tissues including the brain where they regulate appetite and emotion. Upon NPY stimulation, the neuropeptide Y1 and Y2 receptors (YR and YR, respectively) activate G signaling, but their physiological responses to food intake are different. In addition, deletion of the two N-terminal amino acids of peptide YY (PYY(3-36)), the endogenous form found in circulation, can stimulate YR but not YR, suggesting that YR and YR may have distinct ligand-binding modes. Here, we report the cryo-electron microscopy structures of the PYY(3-36)‒YR‒G and NPY‒YR‒G complexes. Using cell-based assays, molecular dynamics simulations, and structural analysis, we revealed the molecular basis of the exclusive binding of PYY(3-36) to YR. Furthermore, we demonstrated that YR favors G protein signaling over β-arrestin signaling upon activation, whereas YR does not show a preference between these two pathways. #1:  ジャーナル: Acta Crystallogr D Struct Biol / 年: 2018 ジャーナル: Acta Crystallogr D Struct Biol / 年: 2018タイトル: Real-space refinement in PHENIX for cryo-EM and crystallography. 著者: Afonine PV / Poon BK / Read RJ / Sobolev OV / Terwilliger TC / Urzhumtsev A / Adams PD | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33985.map.gz emd_33985.map.gz | 229.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33985-v30.xml emd-33985-v30.xml emd-33985.xml emd-33985.xml | 27 KB 27 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_33985.png emd_33985.png | 43.1 KB | ||
| その他 |  emd_33985_additional_1.map.gz emd_33985_additional_1.map.gz emd_33985_additional_2.map.gz emd_33985_additional_2.map.gz | 230 MB 230.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33985 http://ftp.pdbj.org/pub/emdb/structures/EMD-33985 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33985 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33985 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33985_validation.pdf.gz emd_33985_validation.pdf.gz | 429.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33985_full_validation.pdf.gz emd_33985_full_validation.pdf.gz | 429.3 KB | 表示 | |
| XML形式データ |  emd_33985_validation.xml.gz emd_33985_validation.xml.gz | 7.1 KB | 表示 | |
| CIF形式データ |  emd_33985_validation.cif.gz emd_33985_validation.cif.gz | 8.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33985 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33985 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33985 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33985 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7yooMC  7yonC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33985.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33985.map.gz / 形式: CCP4 / 大きさ: 244.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Composite map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8415 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: Local refined map of NPY-Y2R
| ファイル | emd_33985_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refined map of NPY-Y2R | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Local refined map of G-protein complex
| ファイル | emd_33985_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refined map of G-protein complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Complex structure of NPY-Y2R-Gi-scFv16
+超分子 #1: Complex structure of NPY-Y2R-Gi-scFv16
+超分子 #2: Guanine nucleotide-binding protein
+超分子 #3: scFv16
+超分子 #4: NPY
+分子 #1: Guanine nucleotide-binding protein G(i) subunit alpha-1
+分子 #2: Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1
+分子 #3: Guanine nucleotide-binding protein G(I)/G(S)/G(O) subunit gamma-2
+分子 #4: Neuropeptide Y
+分子 #5: Neuropeptide Y receptor type 2
+分子 #6: single-chain antibody Fv fragment (scFv16)
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 10 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 278 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 66.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.25 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー











































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)
































 Trichoplusia ni (イラクサキンウワバ)
Trichoplusia ni (イラクサキンウワバ)

