+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the human ABCB6 (coproporphyrin III-bound) | |||||||||||||||
 マップデータ マップデータ | generated from non-uniform refinement in cryosparc | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | ABCB6 / heme transporter / MEMBRANE PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Defective ABCB6 causes MCOPCB7 / cellular detoxification of cadmium ion / Mitochondrial ABC transporters / tetrapyrrole metabolic process / ABC-type heme transporter / porphyrin-containing compound metabolic process / tetrapyrrole binding / heme metabolic process / porphyrin-containing compound biosynthetic process / heme transport ...Defective ABCB6 causes MCOPCB7 / cellular detoxification of cadmium ion / Mitochondrial ABC transporters / tetrapyrrole metabolic process / ABC-type heme transporter / porphyrin-containing compound metabolic process / tetrapyrrole binding / heme metabolic process / porphyrin-containing compound biosynthetic process / heme transport / melanosome assembly / ABC-type heme transporter activity / heme transmembrane transport / melanosome membrane / multivesicular body membrane / mitochondrial envelope / endolysosome membrane / vacuolar membrane / skin development / efflux transmembrane transporter activity / intracellular copper ion homeostasis / ABC-type transporter activity / ATP-binding cassette (ABC) transporter complex / brain development / transmembrane transport / early endosome membrane / mitochondrial outer membrane / intracellular iron ion homeostasis / endosome / Golgi membrane / lysosomal membrane / heme binding / endoplasmic reticulum membrane / endoplasmic reticulum / Golgi apparatus / ATP hydrolysis activity / mitochondrion / extracellular exosome / nucleoplasm / ATP binding / plasma membrane / cytosol 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||||||||
 データ登録者 データ登録者 | Kim S / Lee SS | |||||||||||||||
| 資金援助 |  韓国, 4件 韓国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Mol Cells / 年: 2022 ジャーナル: Mol Cells / 年: 2022タイトル: Structural Insights into Porphyrin Recognition by the Human ATP-Binding Cassette Transporter ABCB6. 著者: Songwon Kim / Sang Soo Lee / Jun Gyou Park / Ji Won Kim / Seulgi Ju / Seung Hun Choi / Subin Kim / Na Jin Kim / Semi Hong / Jin Young Kang / Mi Sun Jin /  要旨: Human ABCB6 is an ATP-binding cassette transporter that regulates heme biosynthesis by translocating various porphyrins from the cytoplasm into the mitochondria. Here we report the cryo-electron ...Human ABCB6 is an ATP-binding cassette transporter that regulates heme biosynthesis by translocating various porphyrins from the cytoplasm into the mitochondria. Here we report the cryo-electron microscopy (cryo-EM) structures of human ABCB6 with its substrates, coproporphyrin III (CPIII) and hemin, at 3.5 and 3.7 Å resolution, respectively. Metalfree porphyrin CPIII binds to ABCB6 within the central cavity, where its propionic acids form hydrogen bonds with the highly conserved Y550. The resulting structure has an overall fold similar to the inward-facing apo structure, but the two nucleotide-binding domains (NBDs) are slightly closer to each other. In contrast, when ABCB6 binds a metal-centered porphyrin hemin in complex with two glutathione molecules (1 hemin: 2 glutathione), the two NBDs end up much closer together, aligning them to bind and hydrolyze ATP more efficiently. In our structures, a glycine-rich and highly flexible "bulge" loop on TM helix 7 undergoes significant conformational changes associated with substrate binding. Our findings suggest that ABCB6 utilizes at least two distinct mechanisms to fine-tune substrate specificity and transport efficiency. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_30790.map.gz emd_30790.map.gz | 141.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-30790-v30.xml emd-30790-v30.xml emd-30790.xml emd-30790.xml | 15.6 KB 15.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_30790.png emd_30790.png | 30.6 KB | ||
| Filedesc metadata |  emd-30790.cif.gz emd-30790.cif.gz | 6.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-30790 http://ftp.pdbj.org/pub/emdb/structures/EMD-30790 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30790 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30790 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_30790_validation.pdf.gz emd_30790_validation.pdf.gz | 463.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_30790_full_validation.pdf.gz emd_30790_full_validation.pdf.gz | 463.2 KB | 表示 | |
| XML形式データ |  emd_30790_validation.xml.gz emd_30790_validation.xml.gz | 6.8 KB | 表示 | |
| CIF形式データ |  emd_30790_validation.cif.gz emd_30790_validation.cif.gz | 7.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30790 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30790 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30790 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30790 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7dnyMC  7dnzC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_30790.map.gz / 形式: CCP4 / 大きさ: 149.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_30790.map.gz / 形式: CCP4 / 大きさ: 149.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | generated from non-uniform refinement in cryosparc | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.656 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : ABCB6
| 全体 | 名称: ABCB6 |
|---|---|
| 要素 |
|
-超分子 #1: ABCB6
| 超分子 | 名称: ABCB6 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: ATP-binding cassette sub-family B member 6, mitochondrial
| 分子 | 名称: ATP-binding cassette sub-family B member 6, mitochondrial タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 93.974172 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MVTVGNYCEA EGPVGPAWMQ DGLSPCFFFT LVPSTRMALG TLALVLALPC RRRERPAGAD SLSWGAGPRI SPYVLQLLLA TLQAALPLA GLAGRVGTAR GAPLPSYLLL ASVLESLAGA CGLWLLVVER SQARQRLAMG IWIKFRHSPG LLLLWTVAFA A ENLALVSW ...文字列: MVTVGNYCEA EGPVGPAWMQ DGLSPCFFFT LVPSTRMALG TLALVLALPC RRRERPAGAD SLSWGAGPRI SPYVLQLLLA TLQAALPLA GLAGRVGTAR GAPLPSYLLL ASVLESLAGA CGLWLLVVER SQARQRLAMG IWIKFRHSPG LLLLWTVAFA A ENLALVSW NSPQWWWARA DLGQQVQFSL WVLRYVVSGG LFVLGLWAPG LRPQSYTLQV HEEDQDVERS QVRSAAQQST WR DFGRKLR LLSGYLWPRG SPALQLVVLI CLGLMGLERA LNVLVPIFYR NIVNLLTEKA PWNSLAWTVT SYVFLKFLQG GGT GSTGFV SNLRTFLWIR VQQFTSRRVE LLIFSHLHEL SLRWHLGRRT GEVLRIADRG TSSVTGLLSY LVFNVIPTLA DIII GIIYF SMFFNAWFGL IVFLCMSLYL TLTIVVTEWR TKFRRAMNTQ ENATRARAVD SLLNFETVKY YNAESYEVER YREAI IKYQ GLEWKSSASL VLLNQTQNLV IGLGLLAGSL LCAYFVTEQK LQVGDYVLFG TYIIQLYMPL NWFGTYYRMI QTNFID MEN MFDLLKEETE VKDLPGAGPL RFQKGRIEFE NVHFSYADGR ETLQDVSFTV MPGQTLALVG PSGAGKSTIL RLLFRFY DI SSGCIRIDGQ DISQVTQASL RSHIGVVPQD TVLFNDTIAD NIRYGRVTAG NDEVEAAAQA AGIHDAIMAF PEGYRTQV G ERGLKLSGGE KQRVAIARTI LKAPGIILLD EATSALDTSN ERAIQASLAK VCANRTTIVV AHRLSTVVNA DQILVIKDG CIVERGRHEA LLSRGGVYAD MWQLQQGQEE TSEDTKPQTM ER UniProtKB: ATP-binding cassette sub-family B member 6 |
-分子 #2: CHOLESTEROL HEMISUCCINATE
| 分子 | 名称: CHOLESTEROL HEMISUCCINATE / タイプ: ligand / ID: 2 / コピー数: 5 / 式: Y01 |
|---|---|
| 分子量 | 理論値: 486.726 Da |
| Chemical component information |  ChemComp-Y01: |
-分子 #3: coproporphyrin III
| 分子 | 名称: coproporphyrin III / タイプ: ligand / ID: 3 / コピー数: 1 / 式: HT9 |
|---|---|
| 分子量 | 理論値: 654.709 Da |
| Chemical component information | 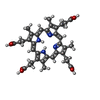 ChemComp-HT9: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 6 mg/mL |
|---|---|
| 緩衝液 | pH: 7 / 構成要素 - 濃度: 200.0 mM / 構成要素 - 式: NaCl / 構成要素 - 名称: sodium chloride |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | This sample was monodisperse. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-7dny: |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















