+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of NLR family apoptosis inhibitory protein 5 (NAIP5) in complex with a full-length flagellin (FliC) ligand | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Inflammasome / Innate immunity / Bacterial ligand / host-pathogen interaction / Protein complex / IMMUNE SYSTEM | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報TLR5 cascade / MyD88 cascade initiated on plasma membrane / NFkB and MAPK activation mediated by TRAF6 / IPAF inflammasome complex / The IPAF inflammasome / bacterial-type flagellum / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / pyroptotic inflammatory response / detection of bacterium / positive regulation of interleukin-1 beta production ...TLR5 cascade / MyD88 cascade initiated on plasma membrane / NFkB and MAPK activation mediated by TRAF6 / IPAF inflammasome complex / The IPAF inflammasome / bacterial-type flagellum / cysteine-type endopeptidase inhibitor activity involved in apoptotic process / pyroptotic inflammatory response / detection of bacterium / positive regulation of interleukin-1 beta production / defense response to Gram-negative bacterium / defense response to bacterium / inflammatory response / receptor ligand activity / innate immune response / apoptotic process / symbiont entry into host cell / negative regulation of apoptotic process / structural molecule activity / extracellular space / ATP binding / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |   Salmonella enterica subsp. enterica serovar Typhimurium str. LT2 (サルモネラ菌) Salmonella enterica subsp. enterica serovar Typhimurium str. LT2 (サルモネラ菌) | |||||||||
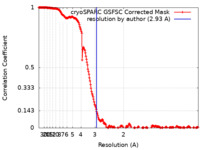
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.93 Å | |||||||||
 データ登録者 データ登録者 | Paidimuddala B / Zhang L | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Sci Adv / 年: 2023 ジャーナル: Sci Adv / 年: 2023タイトル: Structural basis for flagellin-induced NAIP5 activation. 著者: Bhaskar Paidimuddala / Jianhao Cao / Liman Zhang /  要旨: The NAIP (NLR family apoptosis inhibitory protein)/NLRC4 (NLR family CARD containing protein 4) inflammasome senses Gram-negative bacterial ligand. In the ligand-bound state, the winged helix domain ...The NAIP (NLR family apoptosis inhibitory protein)/NLRC4 (NLR family CARD containing protein 4) inflammasome senses Gram-negative bacterial ligand. In the ligand-bound state, the winged helix domain of NAIP forms a steric clash with NLRC4 to open it up. However, how ligand binding activates NAIP is less clear. Here, we investigated the dynamics of the ligand-binding region of inactive NAIP5 and solved the cryo-EM structure of NAIP5 in complex with its specific ligand, FliC from flagellin, at 2.9-Å resolution. The structure revealed a "trap and lock" mechanism in FliC recognition, whereby FliC-D0 is first trapped by the hydrophobic pocket of NAIP5, then locked in the binding site by ID (insertion domain) and C-terminal tail of NAIP5. The FliC-D0 domain further inserts into ID to stabilize the complex. According to this mechanism, FliC triggers the conformational change of NAIP5 by bringing multiple flexible domains together. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29296.map.gz emd_29296.map.gz | 785.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29296-v30.xml emd-29296-v30.xml emd-29296.xml emd-29296.xml | 17.6 KB 17.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29296_fsc.xml emd_29296_fsc.xml | 20.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29296.png emd_29296.png | 120.6 KB | ||
| Filedesc metadata |  emd-29296.cif.gz emd-29296.cif.gz | 6.9 KB | ||
| その他 |  emd_29296_half_map_1.map.gz emd_29296_half_map_1.map.gz emd_29296_half_map_2.map.gz emd_29296_half_map_2.map.gz | 877.2 MB 877.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29296 http://ftp.pdbj.org/pub/emdb/structures/EMD-29296 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29296 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29296 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29296_validation.pdf.gz emd_29296_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29296_full_validation.pdf.gz emd_29296_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_29296_validation.xml.gz emd_29296_validation.xml.gz | 29.7 KB | 表示 | |
| CIF形式データ |  emd_29296_validation.cif.gz emd_29296_validation.cif.gz | 38.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29296 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29296 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29296 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29296 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8fmlMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29296.map.gz / 形式: CCP4 / 大きさ: 944.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29296.map.gz / 形式: CCP4 / 大きさ: 944.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.528 Å | ||||||||||||||||||||||||||||||||||||
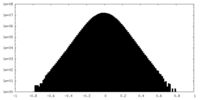
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_29296_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
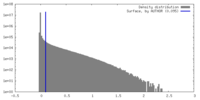
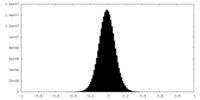
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_29296_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
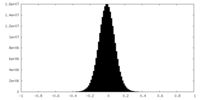
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : NAIP5 in complex with a full-length bacterial flagellin ligand (FliC)
| 全体 | 名称: NAIP5 in complex with a full-length bacterial flagellin ligand (FliC) |
|---|---|
| 要素 |
|
-超分子 #1: NAIP5 in complex with a full-length bacterial flagellin ligand (FliC)
| 超分子 | 名称: NAIP5 in complex with a full-length bacterial flagellin ligand (FliC) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 213.5 KDa |
-分子 #1: Baculoviral IAP repeat-containing protein 1e
| 分子 | 名称: Baculoviral IAP repeat-containing protein 1e / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 161.128156 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MDYKDDDDKL AEHGESSEDR ISEIDYEFLP ELSALLGVDA FQVAKSQEEE EHKERMKMKK GFNSQMRSEA KRLKTFETYD TFRSWTPQE MAAAGFYHTG VRLGVQCFCC SLILFGNSLR KLPIERHKKL RPECEFLQGK DVGNIGKYDI RVKRPEKMLR G GKARYHEE ...文字列: MDYKDDDDKL AEHGESSEDR ISEIDYEFLP ELSALLGVDA FQVAKSQEEE EHKERMKMKK GFNSQMRSEA KRLKTFETYD TFRSWTPQE MAAAGFYHTG VRLGVQCFCC SLILFGNSLR KLPIERHKKL RPECEFLQGK DVGNIGKYDI RVKRPEKMLR G GKARYHEE EARLESFEDW PFYAHGTSPR VLSAAGFVFT GKRDTVQCFS CGGSLGNWEE GDDPWKEHAK WFPKCEFLQS KK SSEEIAQ YIQSYEGFVH VTGEHFVKSW VRRELPMVSA YCNDSVFANE ELRMDMFKDW PQESPVGVEA LVRAGFFYTG KKD IVRCFS CGGCLEKWAE GDDPMEDHIK FFPECVFLQT LKSSAEVIPT LQSQYALPEA TETTRESNHG DAAAVHSTVV DLGR SEAQW FQEARSLSEQ LRDNYTKATF RHMNLPEVCS SLGTDHLLSC DVSIISKHIS QPVQEALTIP EVFSNLNSVM CVEGE TGSG KTTFLKRIAF LWASGCCPLL YRFQLVFYLS LSSITPDQGL ANIICAQLLG AGGCISEVCL SSSIQQLQHQ VLFLLD DYS GLASLPQALH TLITKNYLSR TCLLIAVHTN RVRDIRLYLG TSLEIQEFPF YNTVSVLRKF FSHDIICVEK LIIYFID NK DLQGVYKTPL FVAAVCTDWI QNASAQDKFQ DVTLFQSYMQ YLSLKYKATA EPLQATVSSC GQLALTGLFS SCFEFNSD D LAEAGVDEDE KLTTLLMSKF TAQRLRPVYR FLGPLFQEFL AAVRLTELLS SDRQEDQDLG LYYLRQIDSP LKAINSFNI FLYYVSSHSS SKAAPTVVSH LLQLVDEKES LENMSENEDY MKLHPQTFLW FQFVRGLWLV SPESSSSFVS EHLLRLALIF AYESNTVAE CSPFILQFLR GKTLALRVLN LQYFRDHPES LLLLRSLKVS INGNKMSSYV DYSFKTYFEN LQPPAIDEEY T SAFEHISE WRRNFAQDEE IIKNYENIRP RALPDISEGY WKLSPKPCKI PKLEVQVNNT DAADQALLQV LMEVFSASQS IE FRLFNSS GFLESICPAL ELSKASVTKC SMSRLELSRA EQELLLTLPA LQSLEVSETN QLPEQLFHNL HKFLGLKELC VRL DGKPNV LSVLPREFPN LLHMEKLSIQ TSTESDLSKL VKFIQNFPNL HVFHLKCDFL SNCESLMAVL ASCKKLREIE FSGR CFEAM TFVNILPNFV SLKILNLKDQ QFPDKETSEK FAQALGSLRN LEELLVPTGD GIHQVAKLIV RQCLQLPCLR VLTFH DILD DDSVIEIARA ATSGGFQKLE NLDISMNHKI TEEGYRNFFQ ALDNLPNLQE LNICRNIPGR IQVQATTVKA LGQCVS RLP SLIRLHMLSW LLDEEDMKVI NDVKERHPQS KRLIIFWKLI VPFSPVILE UniProtKB: Baculoviral IAP repeat-containing protein 1e |
-分子 #2: Flagellin
| 分子 | 名称: Flagellin / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Salmonella enterica subsp. enterica serovar Typhimurium str. LT2 (サルモネラ菌) Salmonella enterica subsp. enterica serovar Typhimurium str. LT2 (サルモネラ菌) |
| 分子量 | 理論値: 52.614418 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MHHHHHHMAQ VINTNSLSLL TQNNLNKSQS ALGTAIERLS SGLRINSAKD DAAGQAIANR FTANIKGLTQ ASRNANDGIS IAQTTEGAL NEINNNLQRV RELAVQSANS TNSQSDLDSI QAEITQRLNE IDRVSGQTQF NGVKVLAQDN TLTIQVGAND G ETIDIDLK ...文字列: MHHHHHHMAQ VINTNSLSLL TQNNLNKSQS ALGTAIERLS SGLRINSAKD DAAGQAIANR FTANIKGLTQ ASRNANDGIS IAQTTEGAL NEINNNLQRV RELAVQSANS TNSQSDLDSI QAEITQRLNE IDRVSGQTQF NGVKVLAQDN TLTIQVGAND G ETIDIDLK QINSQTLGLD TLNVQQKYKV SDTAATVTGY ADTTIALDNS TFKASATGLG GTDQKIDGDL KFDDTTGKYY AK VTVTGGT GKDGYYEVSV DKTNGEVTLA GGATSPLTGG LPATATEDVK NVQVANADLT EAKAALTAAG VTGTASVVKM SYT DNNGKT IDGGLAVKVG DDYYSATQNK DGSISINTTK YTADDGTSKT ALNKLGGADG KTEVVSIGGK TYAASKAEGH NFKA QPDLA EAAATTTENP LQKIDAALAQ VDTLRSDLGA VQNRFNSAIT NLGNTVNNLT SARSRIEDSD YATEVSNMSR AQILQ QAGT SVLAQANQVP QNVLSLLR UniProtKB: Flagellin |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | cell |
- 試料調製
試料調製
| 濃度 | 1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 4616 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: BACKBONE TRACE |
|---|---|
| 得られたモデル |  PDB-8fml: |
 ムービー
ムービー コントローラー
コントローラー






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)