+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Recombinant mouse RyR2 triple phosphomimetic mutant S2807D/S2813D/S2030D in complex with FKBP12.6 and nanodisc under open-state conditions | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Ryanodine receptor / Calcium channel / Mutation / Triple mutant / RyR2 / Phosphorylation / MEMBRANE PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報establishment of protein localization to endoplasmic reticulum / type B pancreatic cell apoptotic process / Purkinje myocyte to ventricular cardiac muscle cell signaling / regulation of atrial cardiac muscle cell action potential / left ventricular cardiac muscle tissue morphogenesis / suramin binding / regulation of AV node cell action potential / regulation of SA node cell action potential / Stimuli-sensing channels / regulation of ventricular cardiac muscle cell action potential ...establishment of protein localization to endoplasmic reticulum / type B pancreatic cell apoptotic process / Purkinje myocyte to ventricular cardiac muscle cell signaling / regulation of atrial cardiac muscle cell action potential / left ventricular cardiac muscle tissue morphogenesis / suramin binding / regulation of AV node cell action potential / regulation of SA node cell action potential / Stimuli-sensing channels / regulation of ventricular cardiac muscle cell action potential / ventricular cardiac muscle cell action potential / positive regulation of sequestering of calcium ion / negative regulation of calcium-mediated signaling / embryonic heart tube morphogenesis / cardiac muscle hypertrophy / Ion homeostasis / negative regulation of insulin secretion involved in cellular response to glucose stimulus / neuronal action potential propagation / negative regulation of release of sequestered calcium ion into cytosol / calcium ion transport into cytosol / insulin secretion involved in cellular response to glucose stimulus / ryanodine-sensitive calcium-release channel activity / response to caffeine / response to redox state / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / 'de novo' protein folding / negative regulation of heart rate / cellular response to caffeine / calcium ion transmembrane import into cytosol / FK506 binding / response to muscle activity / protein kinase A regulatory subunit binding / protein kinase A catalytic subunit binding / positive regulation of the force of heart contraction / intracellularly gated calcium channel activity / smooth endoplasmic reticulum / smooth muscle contraction / detection of calcium ion / T cell proliferation / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / positive regulation of heart rate / calcium channel inhibitor activity / Ion homeostasis / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / response to muscle stretch / release of sequestered calcium ion into cytosol / cellular response to epinephrine stimulus / calcium channel complex / sarcoplasmic reticulum membrane / regulation of heart rate / protein maturation / sarcoplasmic reticulum / sarcomere / calcium channel regulator activity / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / establishment of localization in cell / calcium-mediated signaling / calcium ion transmembrane transport / calcium channel activity / Stimuli-sensing channels / Z disc / intracellular calcium ion homeostasis / calcium ion transport / positive regulation of cytosolic calcium ion concentration / protein refolding / transmembrane transporter binding / calmodulin binding / response to hypoxia / signaling receptor binding / calcium ion binding / protein kinase binding / enzyme binding / protein-containing complex / identical protein binding / membrane / cytoplasm 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
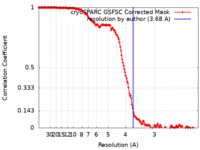
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.68 Å | |||||||||||||||
 データ登録者 データ登録者 | Iyer KA / Hu Y / Murayama T / Samso M | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Recombinant mouse RyR2 triple phosphomimetic mutant S2807D/S2813D/S2030D in complex with FKBP12.6 and nanodisc under open-state conditions 著者: Hu Y / Iyer KA / Nayak AR / Eltit JM / Kurebayashi N / Murayama T / Samso M | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27746.map.gz emd_27746.map.gz | 342.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27746-v30.xml emd-27746-v30.xml emd-27746.xml emd-27746.xml | 25.1 KB 25.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_27746_fsc.xml emd_27746_fsc.xml | 15.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27746.png emd_27746.png | 269.5 KB | ||
| Filedesc metadata |  emd-27746.cif.gz emd-27746.cif.gz | 9.6 KB | ||
| その他 |  emd_27746_half_map_1.map.gz emd_27746_half_map_1.map.gz emd_27746_half_map_2.map.gz emd_27746_half_map_2.map.gz | 336.6 MB 336.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27746 http://ftp.pdbj.org/pub/emdb/structures/EMD-27746 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27746 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27746 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27746_validation.pdf.gz emd_27746_validation.pdf.gz | 970.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27746_full_validation.pdf.gz emd_27746_full_validation.pdf.gz | 969.7 KB | 表示 | |
| XML形式データ |  emd_27746_validation.xml.gz emd_27746_validation.xml.gz | 23.5 KB | 表示 | |
| CIF形式データ |  emd_27746_validation.cif.gz emd_27746_validation.cif.gz | 30.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27746 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27746 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27746 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27746 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8dvvMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27746.map.gz / 形式: CCP4 / 大きさ: 371.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27746.map.gz / 形式: CCP4 / 大きさ: 371.3 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_27746_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_27746_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Recombinant mouse RyR2 triple phosphomimetic mutant S2807D/S2813D...
| 全体 | 名称: Recombinant mouse RyR2 triple phosphomimetic mutant S2807D/S2813D/S2030D in complex with FKBP12.6 and nanodisc under open-state conditions |
|---|---|
| 要素 |
|
-超分子 #1: Recombinant mouse RyR2 triple phosphomimetic mutant S2807D/S2813D...
| 超分子 | 名称: Recombinant mouse RyR2 triple phosphomimetic mutant S2807D/S2813D/S2030D in complex with FKBP12.6 and nanodisc under open-state conditions タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 2.26 MDa |
-分子 #1: Ryanodine receptor 2
| 分子 | 名称: Ryanodine receptor 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 565.62 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MADAGEGEDE IQFLRTDDEV VLQCTATIHK EQQKLCLAAE GFGNRLCFLE STSNSKNVPP DLSICTFVLE QSLSVRALQE MLANTVEKS EGQVDVEKWK FMMKTAQGGG HRTLLYGHAI LLRHSYSGMY LCCLSTSRSS TDKLAFDVGL QEDTTGEACW W TIHPASKQ ...文字列: MADAGEGEDE IQFLRTDDEV VLQCTATIHK EQQKLCLAAE GFGNRLCFLE STSNSKNVPP DLSICTFVLE QSLSVRALQE MLANTVEKS EGQVDVEKWK FMMKTAQGGG HRTLLYGHAI LLRHSYSGMY LCCLSTSRSS TDKLAFDVGL QEDTTGEACW W TIHPASKQ RSEGEKVRVG DDLILVSVSS ERYLHLSYGN SSWHVDAAFQ QTLWSVAPIS SGSEAAQGYL IGGDVLRLLH GH MDECLTV PSGEHGEEQR RTVHYEGGAV SVHARSLWRL ETLRVAWSGS HIRWGQPFRL RHVTTGKYLS LMEDKNLLLM DKE KADVKS TAFAFRSSKE KLDVGVRKEV DGMGTSEIKY GDSICYIQHV DTGLWLTYQA VDVKSARMGS IQRKAIMHHE GHMD DGLNL SRSQHEESRT ARVIRSTVFL FNRFIRGLDA LSKKVKLPTI DLPIESVSLS LQDLIGYFHP PDEHLEHEDK QNRLR ALKN RQNLFQEEGM INLVLECIDR LHVYSSAAHF ADVAGREAGE SWKSILNSLY ELLAALIRGN RKNCAQFSGS LDWLIS RLE RLEASSGILE VLHCVLVESP EALNIIKEGH IKSIISLLDK HGRNHKVLDV LCSLCVCHGV AVRSNQHLIC DNLLPGR DL LLQTRLVNHV SSMRPNIFLG VSEGSAQYKK WYYELMVDHT EPFVTAEATH LRVGWASTEG YSPYPGGGEE WGGNGVGD D LFSYGFDGLH LWSGCIARTV SSPNQHLLRT DDVISCCLDL SAPSISFRIN GQPVQGMFEN FNIDGLFFPV VSFSAGIKV RFLLGGRHGE FKFLPPPGYA ACYEAVLPKE KLKVEHSREY KQERTYTRDL LGPTVSLTQA AFTPVPVDTS QIVLPPHLER IRERLAENI HELWVMNKIE LGWQYGPVRD DNKRQHPCLV EFCKLPEQER NYNLQMSLET LKTLLALGCH VGIADEHAEE K VKKMKLPK NYQLTSGYKP APMDLSFIKL TPSQEAMVDK LAENAHNVWA RDRIRQGWTY GIQQDVKNRR NPRLVPYTLL DD RTKKSNK DSLREAVRTL LGYGYHLEAP DQDHASRAEV CSGTGERFRI FRAEKTYAVK AGRWYFEFEA VTAGDMRVGW SRP GCQPDL ELGSDDRAFA FDGFKAQRWH QGNEHYGRSW QAGDVVGCMV DMNEHTMMFT LNGEILLDDS GSELAFKDFD VGDG FIPVC SLGVAQVGRM NFGKDVSTLK YFTICGLQEG YEPFAVNTNR DITMWLSKRL PQFLQVPSNH EHIEVTRIDG TIDSS PCLK VTQKSFGSQN NNTDIMFYRL SMPIECAEVF SKSVAGGLPG AGFYGPKNDL EDFDVDSDFE VLMKTAHGHL VPDRID KDK ETPKPEFNNH KDYAQEKPSR LKQRFLLRRT KPDYSTGHSA RLTEDVLADD RDDYEYLMQT STYYYSVRIF PGQEPAN VW VGWITSDFHQ YDTGFDLDRV RTVTVTLGDE KGKVHESIKR SNCYMVCAGE SMSPGQGRNN SNGLEIGCVV DAASGLLT F IANGKELSTY YQVEPSTKLF PAVFAQATSP NVFQFELGRI KNVMPLSAGL FKSEHKNPVP QCPPRLHVQF LSHVLWSRM PNQFLKVDVS RISERQGWLV QCLDPLQFMS LHIPEENRSV DILELTEQEE LLQFHYHTLR LYSAVCALGN HRVAHALCSH VDEPQLLYA IENKYMPGLL RAGYYDLLID IHLSSYATAR LMMNNEFIVP MTEETKSITL FPDENKKHGL PGIGLSTSLR P RMRFSSPS FVSISNDCYQ YSPEFPLDIL KAKTIQMLTE AVKEGSLHAR DPVGGTTEFL FVPLIKLFYT LLIMGIFHNE DL KHILQLI EPSVFKEAAV PEEEGGTPEK EISIEDAKLE GEEEAKGGKR PKEGLLQMKL PEPVKLQMCL LLQYLCDCQV RHR IEAIVA FSDDFVAKLQ DNQRFRYNEV MQALNMSAAL TARKTREFRS PPQEQINMLL NFKDDKSECP CPEEIRDQLL DFHE DLMTH CGIELDEDGS LDGSNDLTIR GRLLDLVEKV TYLKKKQAEK PVASDSRKCS SLQQLISETM VRWAQESVIE DPELV RAMF VLLHRQYDGI GGLVRALPKT YTINGVSVED TINLLASLGQ IRSLLSVRMG KEEEKLMIRG LGDIMNNKVF YQHPNL MRA LGMHETVMEV MVNVLGGGES KEITFPKMVA NCCRFLCYFC RISRQNQKAM FDHLSYLLEN SSVGLASPAM RGSTPLD VA AASVMDNNEL ALALREPDLE KVVRYLAGCG LQSCQMLVSK GYPDIGWNPV EGERYLDFLR FAVFCNGESV EENANVVV R LLIRRPECFG PALRGEGGNG LLAAMEEAIK IAEDPSRDGP SPTSGSSKTL DIEEEEDDTI HMGNAIMTFY AALIDLLGR CAPEMHLIHA GKGEAIRIRS ILRSLIPLGD LVGVISIAFQ MPTIAKDGKV VEPDMSAGFC PDHKAAMVLF LDRVYGIEVQ DFLLHLLEV GFLPDLRAAA SLDTAALSAT DMALALNRYL CTAVLPLLTR CAPLFAGTEH HASLIDSLLH TVYRLSKGCS L TKAQRDSI EVCLLSICGQ LRPSMMQHLL RRLVFDVPLL NEHAKMPLKL LTNHYERCWK YYCLPGGWGN FGAASEEELH LS RKLFWGI FDALSQKKYE QELFKLALPC LSAVAGALPP DYMESNYVSM MEKQSSMDSE GNFNPQPVDT SNITIPEKLE YFI NKYAEH SHDKWSMDKL ANGWIYGEIY SDSSKIQPLM KPYKLLSEKE KEIYRWPIKE SLKTMLAWGW RIERTREGDS MALY NRTRR IDQTSQVDID AAHGYSPRAI DMSNVTLSRD LHAMAEMMAE NYHNIWAKKK KLELESKGGG NHPLLVPYDT LTAKE KAKD REKAQDIFKF LQISGYVVSR GFKDLDLDTP SIEKRFAYSF LQQLIRYVDE AHQYILEFDG GSRSKGEHFP YEQEIK FFA KVVLPLIDQY FKNHRLYFLS AASRPLCTGG HASNKEKEMV TSLFCKLGVL VRHRISLFGN DATSIVNCLH ILGQTLD AR TVMKTGLDSV KSALRAFLDN AAEDLEKTME NLKQGQFTHT RSQPKGVTQI INYTTVALLP MLSSLFEHIG QHQFGEDL I LEDVQVSCYR ILTSLYALGT SKSIYVERQR SALGECLAAF AGAFPIAFLE THLDKHNVYS IYNTRSSRER AALSLPANV EDVCPNIPSL EKLMTEIIEL AESGIRYTQM PYMMEVVLPM LCSYMSRWWE HGPENHPERA EMCCTALNSE HMNTLLGNIL KIIYNNLGI DEGAWMKRLA VFSQPIINKV KPQLLKTHFL PLMEKLKKKA AMVVSEEDHL KAEARGDMSE AELLILDEFT T LARDLYAF YPLLIRFVDY NRAKWLKEPN PEAEELFRMV AEVFIYWSKS HNFKREEQNF VVQNEINNMS FLITDTKSKM SK AAISDQE RKKMKRKGDR YSMQTSLIVA ALKRLLPIGL NICAPGDQEL IALAKNRFSL KDTEEEVRDI IRSNIHLQGK LED PAIRWQ MALYKDLPNR TEDPSDPERT VERVLGIANV LFHLEQKSKY TGRGYFSLVE HPQRSKKAVW HKLLSKQRKR AVVA CFRMA PLYNLPRHRA VNLFLQGYEK SWIETEEHYF EDKLIEDLAK PGAELPEEDE AMKRVDPLHQ LILLFSRTAL TEKCK LEED FLYMAYADIM AKSCHDEEDD DGEEEVKSFE EKEMEKQKLL YQQARLHDRG AAEMVLQTIS ASKGETGPMV AATLKL GIA ILNGGNSTVQ QKMLDYLKEK KDVGFFQSLA GLMQSCSVLD LNAFERQNKA EGLGMVTEEG SGEKVLQDDE FTCDLFR FL QLLCEGHNSD FQNYLRTQTG NNTTVNIIIS TVDYLLRVQE SISDFYWYYS GKDIIDEQGQ RNFSKAIQVA KQVFNTLT E YIQGPCTGNQ QSLAHSRLWD AVVGFLHVFA HMQMKLSQDS SQIELLKELM DLQKDMVVML LSMLEGNVVN GTIGKQMVD MLVESSNNVE MILKFFDMFL KLKDLTSSDT FKEYDPDGKG VISKRDFHKA MESHKHYTQS ETEFLLSCAE TDENETLDYE EFVKRFHEP AKDIGFNVAV LLTNLSEHMP NDTRLQTFLE LAESVLNYFQ PFLGRIEIMG SAKRIERVYF EISESSRTQW E KPQVKESK RQFIFDVVNE GGEKEKMELF VNFCEDTIFE MQLAAQISES DLNERLANKE ESEKERPEEQ APRMGFFSLL TI QSALFAL RYNVLTLVRM LSLKSLKKQM KRMKKMTVKD MVLAFFSSYW SVFVTLLHFV ASVCRGFFRI VSSLLLGGSL VEG AKKIKV AELLANMPDP TQDEVRGDEE EGERKPLESA LPSEDLTDLK ELTEESDLLS DIFGLDLKRE GGQYKLIPHN PNAG LSDLM TNPVPVPEVQ EKFQEQKAKE EKEEKEETKS EPEKAEGEDG EKEEKAKDEK SKQKLRQLHT HRYGEPEVPE SAFWK KIIA YQQKLLNYFA RNFYNMRMLA LFVAFAINFI LLFYKVSTSS VVEGKELPTR TSSDTAKVTN SLDSSPHRII AVHYVL EES SGYMEPTLRI LAILHTIISF FCIIGYYCLK VPLVIFKREK EVARKLEFDG LYITEQPSED DIKGQWDRLV INTQSFP NN YWDKFVKRKV MDKYGEFYGR DRISELLGMD KAALDFSDAR EKKKPKKDSS LSAVLNSIDV KYQMWKLGVV FTDNSFLY L AWYMTMSVLG HYNNFFFAAH LLDIAMGFKT LRTILSSVTH NGKQLVLTVG LLAVVVYLYT VVAFNFFRKF YNKSEDGDT PDMKCDDMLT CYMFHMYVGV RAGGGIGDEI EDPAGDEYEI YRIIFDITFF FFVIVILLAI IQGLIIDAFG ELRDQQEQVK EDMETKCFI CGIGNDYFDT VPHGFETHTL QEHNLANYLF FLMYLINKDE TEHTGQESYV WKMYQERCWE FFPAGDCFRK Q YEDQLN UniProtKB: Ryanodine receptor 2 |
-分子 #2: Peptidyl-prolyl cis-trans isomerase FKBP1B
| 分子 | 名称: Peptidyl-prolyl cis-trans isomerase FKBP1B / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO / EC番号: peptidylprolyl isomerase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 11.667305 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GVEIETISPG DGRTFPKKGQ TCVVHYTGML QNGKKFDSSR DRNKPFKFRI GKQEVIKGFE EGAAQMSLGQ RAKLTCTPDV AYGATGHPG VIPPNATLIF DVELLNLE UniProtKB: Peptidyl-prolyl cis-trans isomerase FKBP1B |
-分子 #3: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 3 / コピー数: 4 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-分子 #4: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 4 / コピー数: 4 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2.3 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||||||||||
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 10 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 2 / 実像数: 6123 / 平均露光時間: 2.9 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)