+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the PEAK3/14-3-3 complex | ||||||||||||
 マップデータ マップデータ | Reconstruction of the PEAK3/14-3-3 complex filtered to 3.1A and sharpened with 107.4 bFactor. | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | complex / pseudokinase / kinase / adapter / SIGNALING PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of heart rate by hormone / positive regulation of hippo signaling / membrane repolarization during cardiac muscle cell action potential / Tristetraprolin (TTP, ZFP36) binds and destabilizes mRNA / Butyrate Response Factor 1 (BRF1) binds and destabilizes mRNA / negative regulation of toll-like receptor signaling pathway / protein localization to endoplasmic reticulum / regulation of membrane repolarization / NADE modulates death signalling / MTOR signalling ...regulation of heart rate by hormone / positive regulation of hippo signaling / membrane repolarization during cardiac muscle cell action potential / Tristetraprolin (TTP, ZFP36) binds and destabilizes mRNA / Butyrate Response Factor 1 (BRF1) binds and destabilizes mRNA / negative regulation of toll-like receptor signaling pathway / protein localization to endoplasmic reticulum / regulation of membrane repolarization / NADE modulates death signalling / MTOR signalling / regulation of cell motility / ARMS-mediated activation / RAB GEFs exchange GTP for GDP on RABs / SHOC2 M1731 mutant abolishes MRAS complex function / Gain-of-function MRAS complexes activate RAF signaling / Rap1 signalling / Signaling by Hippo / regulation of potassium ion transmembrane transport / vacuolar membrane / negative regulation of G protein-coupled receptor signaling pathway / protein phosphatase inhibitor activity / negative regulation of protein import into nucleus / Frs2-mediated activation / cytoplasmic pattern recognition receptor signaling pathway / Deregulated CDK5 triggers multiple neurodegenerative pathways in Alzheimer's disease models / negative regulation of calcium ion export across plasma membrane / protein kinase inhibitor activity / intracellular potassium ion homeostasis / regulation of heart rate by cardiac conduction / mTORC1-mediated signalling / Regulation of localization of FOXO transcription factors / Regulation of HSF1-mediated heat shock response / protein localization to nucleus / phosphoserine residue binding / Activation of BAD and translocation to mitochondria / HSF1 activation / regulation of cytosolic calcium ion concentration / potassium channel regulator activity / protein targeting / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / calcium channel inhibitor activity / RHO GTPases activate PKNs / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / signaling adaptor activity / transcription repressor complex / Transcriptional and post-translational regulation of MITF-M expression and activity / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / substantia nigra development / Recruitment of mitotic centrosome proteins and complexes / Recruitment of NuMA to mitotic centrosomes / Anchoring of the basal body to the plasma membrane / protein sequestering activity / regulation of mitotic cell cycle / AURKA Activation by TPX2 / positive regulation of protein export from nucleus / TP53 Regulates Metabolic Genes / regulation of actin cytoskeleton organization / calcium channel regulator activity / Translocation of SLC2A4 (GLUT4) to the plasma membrane / hippocampus development / phosphoprotein binding / RAF activation / Signaling by high-kinase activity BRAF mutants / MAP2K and MAPK activation / cerebral cortex development / mitochondrial membrane / histone deacetylase binding / neuron migration / Negative regulation of MAPK pathway / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / MHC class II protein complex binding / Signaling by BRAF and RAF1 fusions / Regulation of PLK1 Activity at G2/M Transition / intracellular protein localization / melanosome / MAPK cascade / regulation of cell shape / actin cytoskeleton / cellular response to heat / scaffold protein binding / protein phosphatase binding / transmembrane transporter binding / protein kinase activity / intracellular signal transduction / cadherin binding / protein heterodimerization activity / protein domain specific binding / focal adhesion / negative regulation of DNA-templated transcription / ubiquitin protein ligase binding / protein-containing complex binding / perinuclear region of cytoplasm / enzyme binding / endoplasmic reticulum / signal transduction 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
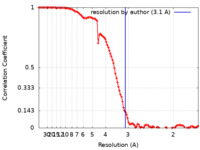
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||||||||
 データ登録者 データ登録者 | Torosyan H / Paul M / Jura N / Verba KA | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Structural insights into regulation of the PEAK3 pseudokinase scaffold by 14-3-3. 著者: Hayarpi Torosyan / Michael D Paul / Antoine Forget / Megan Lo / Devan Diwanji / Krzysztof Pawłowski / Nevan J Krogan / Natalia Jura / Kliment A Verba /   要旨: PEAK pseudokinases are molecular scaffolds which dimerize to regulate cell migration, morphology, and proliferation, as well as cancer progression. The mechanistic role dimerization plays in PEAK ...PEAK pseudokinases are molecular scaffolds which dimerize to regulate cell migration, morphology, and proliferation, as well as cancer progression. The mechanistic role dimerization plays in PEAK scaffolding remains unclear, as there are no structures of PEAKs in complex with their interactors. Here, we report the cryo-EM structure of dimeric PEAK3 in complex with an endogenous 14-3-3 heterodimer. Our structure reveals an asymmetric binding mode between PEAK3 and 14-3-3 stabilized by one pseudokinase domain and the SHED domain of the PEAK3 dimer. The binding interface contains a canonical phosphosite-dependent primary interaction and a unique secondary interaction not observed in previous structures of 14-3-3/client complexes. Additionally, we show that PKD regulates PEAK3/14-3-3 binding, which when prevented leads to PEAK3 nuclear enrichment and distinct protein-protein interactions. Altogether, our data demonstrate that PEAK3 dimerization forms an unusual secondary interface for 14-3-3 binding, facilitating 14-3-3 regulation of PEAK3 localization and interactome diversity. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27630.map.gz emd_27630.map.gz | 118 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27630-v30.xml emd-27630-v30.xml emd-27630.xml emd-27630.xml | 22 KB 22 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_27630_fsc.xml emd_27630_fsc.xml | 11.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27630.png emd_27630.png | 57.6 KB | ||
| マスクデータ |  emd_27630_msk_1.map emd_27630_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-27630.cif.gz emd-27630.cif.gz | 6.7 KB | ||
| その他 |  emd_27630_half_map_1.map.gz emd_27630_half_map_1.map.gz emd_27630_half_map_2.map.gz emd_27630_half_map_2.map.gz | 116 MB 116 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27630 http://ftp.pdbj.org/pub/emdb/structures/EMD-27630 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27630 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27630 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27630_validation.pdf.gz emd_27630_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27630_full_validation.pdf.gz emd_27630_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_27630_validation.xml.gz emd_27630_validation.xml.gz | 19 KB | 表示 | |
| CIF形式データ |  emd_27630_validation.cif.gz emd_27630_validation.cif.gz | 24.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27630 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27630 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27630 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27630 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8dp5MC  8ds6C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27630.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27630.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of the PEAK3/14-3-3 complex filtered to 3.1A and sharpened with 107.4 bFactor. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.835 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_27630_msk_1.map emd_27630_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unfiltered, unsharpened half map.
| ファイル | emd_27630_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered, unsharpened half map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Unfiltered, unsharpened half map.
| ファイル | emd_27630_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unfiltered, unsharpened half map. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex between PEAK3 and 14-3-3 epsilon, beta
| 全体 | 名称: Complex between PEAK3 and 14-3-3 epsilon, beta |
|---|---|
| 要素 |
|
-超分子 #1: Complex between PEAK3 and 14-3-3 epsilon, beta
| 超分子 | 名称: Complex between PEAK3 and 14-3-3 epsilon, beta / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 161.8 KDa |
-分子 #1: Protein PEAK3
| 分子 | 名称: Protein PEAK3 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 52.357031 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MSSPEPPTEP PEPDNPTWST QPTYSNLGQI RAHLLPSKAC RLRTPGSLST NPEPLPPPLP KKILTRTQSL PTRRTLHPSS IQVQPPRRP FLGSHSVDKS QAAVGPACLP AELTFGPADA PLGLSLRDLH SPEAVHTALA ARQLQGLRTI YARLRARLMG G HPGPCHPG ...文字列: MSSPEPPTEP PEPDNPTWST QPTYSNLGQI RAHLLPSKAC RLRTPGSLST NPEPLPPPLP KKILTRTQSL PTRRTLHPSS IQVQPPRRP FLGSHSVDKS QAAVGPACLP AELTFGPADA PLGLSLRDLH SPEAVHTALA ARQLQGLRTI YARLRARLMG G HPGPCHPG HSFRLLDSSP CAESGDALYY RVVRAHEDAW HILVAKVPKP GADVPHPWGL ELQASLSPHF NLQGLCGLVP EG TLPGAPW RGAVALAAEV PERTVAQWLA EACTQPPEEF VWAVALLLLQ LSAALKFLEA WGAALVELRP ENLLLVAPRG CAT TGPPRL LLTDFGRVCL QPPGPPGSPG PHAPQLGSLL RALLSLAAPS TTPLAAGLEL LAAQLTRLRP SASRTRGALQ ALLW GPGPE LRGRGAPLGP WLRALGPWLR VRRGLLVLRL AERAAGGEAP SLEDWLCCEY LAEATESSMG QALALLWDLE GGGGA DYKD DDDKGPV UniProtKB: Protein PEAK3 |
-分子 #2: 14-3-3 protein beta/alpha
| 分子 | 名称: 14-3-3 protein beta/alpha / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 28.114373 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MTMDKSELVQ KAKLAEQAER YDDMAAAMKA VTEQGHELSN EERNLLSVAY KNVVGARRSS WRVISSIEQK TERNEKKQQM GKEYREKIE AELQDICNDV LELLDKYLIP NATQPESKVF YLKMKGDYFR YLSEVASGDN KQTTVSNSQQ AYQEAFEISK K EMQPTHPI ...文字列: MTMDKSELVQ KAKLAEQAER YDDMAAAMKA VTEQGHELSN EERNLLSVAY KNVVGARRSS WRVISSIEQK TERNEKKQQM GKEYREKIE AELQDICNDV LELLDKYLIP NATQPESKVF YLKMKGDYFR YLSEVASGDN KQTTVSNSQQ AYQEAFEISK K EMQPTHPI RLGLALNFSV FYYEILNSPE KACSLAKTAF DEAIAELDTL NEESYKDSTL IMQLLRDNLT LWTSENQGDE GD AGEGEN UniProtKB: 14-3-3 protein beta/alpha |
-分子 #3: 14-3-3 protein epsilon
| 分子 | 名称: 14-3-3 protein epsilon / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 29.2089 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MDDREDLVYQ AKLAEQAERY DEMVESMKKV AGMDVELTVE ERNLLSVAYK NVIGARRASW RIISSIEQKE ENKGGEDKLK MIREYRQMV ETELKLICCD ILDVLDKHLI PAANTGESKV FYYKMKGDYH RYLAEFATGN DRKEAAENSL VAYKAASDIA M TELPPTHP ...文字列: MDDREDLVYQ AKLAEQAERY DEMVESMKKV AGMDVELTVE ERNLLSVAYK NVIGARRASW RIISSIEQKE ENKGGEDKLK MIREYRQMV ETELKLICCD ILDVLDKHLI PAANTGESKV FYYKMKGDYH RYLAEFATGN DRKEAAENSL VAYKAASDIA M TELPPTHP IRLGLALNFS VFYYEILNSP DRACRLAKAA FDDAIAELDT LSEESYKDST LIMQLLRDNL TLWTSDMQGD GE EQNKEAL QDVEDENQ UniProtKB: 14-3-3 protein epsilon |
-分子 #4: Protein PEAK3 fragment
| 分子 | 名称: Protein PEAK3 fragment / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 52.437012 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MSSPEPPTEP PEPDNPTWST QPTYSNLGQI RAHLLPSKAC RLRTPGSLST NPEPLPPPLP KKILTRTQ(SEP)L PTRRTL HPS SIQVQPPRRP FLGSHSVDKS QAAVGPACLP AELTFGPADA PLGLSLRDLH SPEAVHTALA ARQLQGLRTI YARLRAR LM ...文字列: MSSPEPPTEP PEPDNPTWST QPTYSNLGQI RAHLLPSKAC RLRTPGSLST NPEPLPPPLP KKILTRTQ(SEP)L PTRRTL HPS SIQVQPPRRP FLGSHSVDKS QAAVGPACLP AELTFGPADA PLGLSLRDLH SPEAVHTALA ARQLQGLRTI YARLRAR LM GGHPGPCHPG HSFRLLDSSP CAESGDALYY RVVRAHEDAW HILVAKVPKP GADVPHPWGL ELQASLSPHF NLQGLCGL V PEGTLPGAPW RGAVALAAEV PERTVAQWLA EACTQPPEEF VWAVALLLLQ LSAALKFLEA WGAALVELRP ENLLLVAPR GCATTGPPRL LLTDFGRVCL QPPGPPGSPG PHAPQLGSLL RALLSLAAPS TTPLAAGLEL LAAQLTRLRP SASRTRGALQ ALLWGPGPE LRGRGAPLGP WLRALGPWLR VRRGLLVLRL AERAAGGEAP SLEDWLCCEY LAEATESSMG QALALLWDLE G GGGADYKD DDDKGPV UniProtKB: Protein PEAK3 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.1 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: A final concentration of 0.1% of Octyl-beta-Glucoside (C14H28O6) was added to the sample before freezing. | |||||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: AIR | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 278.15 K / 装置: FEI VITROBOT MARK IV / 詳細: blot time = 7s blot force = 4. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 平均電子線量: 69.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)