+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2681 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Assembly principles of the unique cage formed by the AAA+ ATPase RavA hexamer and the lysine decarboxylase LdcI decamer | |||||||||
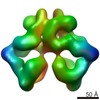
 マップデータ マップデータ | Complex between a decamer of inducible lysine decarboxylase LdcI and ten LARA domains of the AAA+ ATPase RavA | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Lysine decarboxylase / AAA+ ATPase / Acid stress response | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報lysine decarboxylase / lysine catabolic process / lysine decarboxylase activity / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・物質の膜輸送を触媒する / guanosine tetraphosphate binding / ATP hydrolysis activity / ATP binding / identical protein binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.5 Å | |||||||||
 データ登録者 データ登録者 | Malet H / Liu K / El Bakkouri M / Chan SWS / Effantin G / Bacia M / Houry WA / Gutsche I | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2014 ジャーナル: Elife / 年: 2014タイトル: Assembly principles of a unique cage formed by hexameric and decameric E. coli proteins. 著者: Hélène Malet / Kaiyin Liu / Majida El Bakkouri / Sze Wah Samuel Chan / Gregory Effantin / Maria Bacia / Walid A Houry / Irina Gutsche /   要旨: A 3.3 MDa macromolecular cage between two Escherichia coli proteins with seemingly incompatible symmetries-the hexameric AAA+ ATPase RavA and the decameric inducible lysine decarboxylase LdcI-is ...A 3.3 MDa macromolecular cage between two Escherichia coli proteins with seemingly incompatible symmetries-the hexameric AAA+ ATPase RavA and the decameric inducible lysine decarboxylase LdcI-is reconstructed by cryo-electron microscopy to 11 Å resolution. Combined with a 7.5 Å resolution reconstruction of the minimal complex between LdcI and the LdcI-binding domain of RavA, and the previously solved crystal structures of the individual components, this work enables to build a reliable pseudoatomic model of this unusual architecture and to identify conformational rearrangements and specific elements essential for complex formation. The design of the cage created via lateral interactions between five RavA rings is unique for the diverse AAA+ ATPase superfamily. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2681.map.gz emd_2681.map.gz | 28.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2681-v30.xml emd-2681-v30.xml emd-2681.xml emd-2681.xml | 13.3 KB 13.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  EMDB-2681.png EMDB-2681.png | 393.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2681 http://ftp.pdbj.org/pub/emdb/structures/EMD-2681 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2681 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2681 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_2681_validation.pdf.gz emd_2681_validation.pdf.gz | 244.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_2681_full_validation.pdf.gz emd_2681_full_validation.pdf.gz | 243.5 KB | 表示 | |
| XML形式データ |  emd_2681_validation.xml.gz emd_2681_validation.xml.gz | 5.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2681 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2681 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2681 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2681 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2681.map.gz / 形式: CCP4 / 大きさ: 29.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2681.map.gz / 形式: CCP4 / 大きさ: 29.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Complex between a decamer of inducible lysine decarboxylase LdcI and ten LARA domains of the AAA+ ATPase RavA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.464 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Complex between a decamer of inducible lysine decarboxylase LdcI ...
| 全体 | 名称: Complex between a decamer of inducible lysine decarboxylase LdcI and ten LARA domains of the AAA+ ATPase RavA |
|---|---|
| 要素 |
|
-超分子 #1000: Complex between a decamer of inducible lysine decarboxylase LdcI ...
| 超分子 | 名称: Complex between a decamer of inducible lysine decarboxylase LdcI and ten LARA domains of the AAA+ ATPase RavA タイプ: sample / ID: 1000 集合状態: One homodecamer of LdcI bound to ten monomers of LARA domains of the AAA+ ATPase RavA Number unique components: 2 |
|---|---|
| 分子量 | 実験値: 936 KDa / 理論値: 936 KDa |
-分子 #1: Inducible lysine decarboxylase
| 分子 | 名称: Inducible lysine decarboxylase / タイプ: protein_or_peptide / ID: 1 / Name.synonym: LdcI / コピー数: 10 / 集合状態: Homodecamer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 81.2 KDa / 理論値: 81.2 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: Inducible lysine decarboxylase / GO: lysine catabolic process / InterPro: Ornithine/lysine/arginine decarboxylase |
-分子 #2: LARA domain of the AAA+ ATPase RavA
| 分子 | 名称: LARA domain of the AAA+ ATPase RavA / タイプ: protein_or_peptide / ID: 2 / Name.synonym: LARA domain of RavA / コピー数: 10 / 集合状態: monomer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 12.405 KDa / 理論値: 12.405 KDa |
| 組換発現 | 生物種:  |
| 配列 | UniProtKB: ATPase RavA / GO: ATP hydrolysis activity / InterPro: ATPase RavA |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.6 mg/mL |
|---|---|
| 緩衝液 | pH: 6.5 詳細: 50mM MES pH 6.5, 100mM NaCl, 0.2mM PLP, 1mM DTT, 0.01% glutaraldehyde |
| グリッド | 詳細: Quantifoil 400 mesh 2/1 Glow discharged |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 91 K / 装置: FEI VITROBOT MARK III / 手法: Blot for 2 seconds before plunging |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 温度 | 最低: 90 K / 最高: 92 K / 平均: 91 K |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 100,000 times magnification Legacy - Electron beam tilt params: 0 |
| 詳細 | Automatic data acquisition with FEI EPU software |
| 日付 | 2012年9月14日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) 実像数: 911 / 平均電子線量: 20 e/Å2 |
| Tilt angle min | 0 |
| Tilt angle max | 0 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 51660 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2 mm / 最大 デフォーカス(公称値): 2.7 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 51660 |
| 試料ステージ | 試料ホルダー: Nitrogen cooled / 試料ホルダーモデル: GATAN HELIUM |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
- 画像解析
画像解析
| CTF補正 | 詳細: Phase flipping |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: D5 (2回x5回 2面回転対称) アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 7.5 Å / 解像度の算出法: OTHER ソフトウェア - 名称: CTFFIND3, EMAN, boxer, IMAGIC, FPM, SPIDER 使用した粒子像数: 23540 |
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Chain ID: A |
|---|---|
| ソフトウェア | 名称: Flex-EM |
| 詳細 | Three rigid bodies separated by flexible linkers were used for flexible fitting |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 当てはまり具合の基準: Cross-correlation, energy |
| 得られたモデル |  PDB-4upf: |
-原子モデル構築 2
| 初期モデル | PDB ID: Chain - Chain ID: X |
|---|---|
| ソフトウェア | 名称: SITUS |
| 詳細 | The residues 361-434 corresponding to the RavA LARA domain were fitted |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT / 当てはまり具合の基準: Cross-correlation |
| 得られたモデル |  PDB-4upf: |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)























