+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | GltPh mutant (S279E/D405N) in complex with aspartate and sodium ions | ||||||||||||
 マップデータ マップデータ | 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3, 1 mM L-Asp Dataset A | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | outward-facing / substrate-bound / TRANSPORT PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報L-aspartate transmembrane transport / L-aspartate transmembrane transporter activity / amino acid:sodium symporter activity / L-aspartate import across plasma membrane / chloride transmembrane transporter activity / protein homotrimerization / chloride transmembrane transport / metal ion binding / identical protein binding / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Pyrococcus horikoshii (古細菌) / Pyrococcus horikoshii (古細菌) /   Pyrococcus horikoshii (strain ATCC 700860 / DSM 12428 / JCM 9974 / NBRC 100139 / OT-3) (古細菌) Pyrococcus horikoshii (strain ATCC 700860 / DSM 12428 / JCM 9974 / NBRC 100139 / OT-3) (古細菌) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.2 Å | ||||||||||||
 データ登録者 データ登録者 | Reddy KD / Boudker O | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: J Gen Physiol / 年: 2022 ジャーナル: J Gen Physiol / 年: 2022タイトル: The archaeal glutamate transporter homologue GltPh shows heterogeneous substrate binding. 著者: Krishna D Reddy / Didar Ciftci / Amanda J Scopelliti / Olga Boudker /  要旨: Integral membrane glutamate transporters couple the concentrative substrate transport to ion gradients. There is a wealth of structural and mechanistic information about this protein family. Recent ...Integral membrane glutamate transporters couple the concentrative substrate transport to ion gradients. There is a wealth of structural and mechanistic information about this protein family. Recent studies of an archaeal homologue, GltPh, revealed transport rate heterogeneity, which is inconsistent with simple kinetic models; however, its structural and mechanistic determinants remain undefined. Here, we demonstrate that in a mutant GltPh, which exclusively populates the outward-facing state, at least two substates coexist in slow equilibrium, binding the substrate with different apparent affinities. Wild type GltPh shows similar binding properties, and modulation of the substate equilibrium correlates with transport rates. The low-affinity substate of the mutant is transient following substrate binding. Consistently, cryo-EM on samples frozen within seconds after substrate addition reveals the presence of structural classes with perturbed helical packing of the extracellular half of the transport domain in regions adjacent to the binding site. By contrast, an equilibrated structure does not show such classes. The structure at 2.2-Å resolution details a pattern of waters in the intracellular half of the domain and resolves classes with subtle differences in the substrate-binding site. We hypothesize that the rigid cytoplasmic half of the domain mediates substrate and ion recognition and coupling, whereas the extracellular labile half sets the affinity and dynamic properties. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_24405.map.gz emd_24405.map.gz | 19.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-24405-v30.xml emd-24405-v30.xml emd-24405.xml emd-24405.xml | 20.4 KB 20.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_24405.png emd_24405.png | 118.9 KB | ||
| Filedesc metadata |  emd-24405.cif.gz emd-24405.cif.gz | 5.7 KB | ||
| その他 |  emd_24405_additional_1.map.gz emd_24405_additional_1.map.gz emd_24405_additional_2.map.gz emd_24405_additional_2.map.gz emd_24405_additional_3.map.gz emd_24405_additional_3.map.gz emd_24405_additional_4.map.gz emd_24405_additional_4.map.gz | 21 MB 21 MB 21 MB 21 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-24405 http://ftp.pdbj.org/pub/emdb/structures/EMD-24405 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24405 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-24405 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_24405_validation.pdf.gz emd_24405_validation.pdf.gz | 345.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_24405_full_validation.pdf.gz emd_24405_full_validation.pdf.gz | 345.1 KB | 表示 | |
| XML形式データ |  emd_24405_validation.xml.gz emd_24405_validation.xml.gz | 7.8 KB | 表示 | |
| CIF形式データ |  emd_24405_validation.cif.gz emd_24405_validation.cif.gz | 9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24405 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24405 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24405 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-24405 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7rcpMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_24405.map.gz / 形式: CCP4 / 大きさ: 343 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_24405.map.gz / 形式: CCP4 / 大きさ: 343 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3, 1 mM L-Asp Dataset A | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.81156 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3,...
| ファイル | emd_24405_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3, 1 mM L-Asp Dataset A, Class A2-4 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
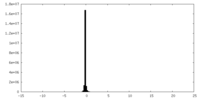
| 密度ヒストグラム |
-追加マップ: 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3,...
| ファイル | emd_24405_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3, 1 mM L-Asp Dataset A, Class A2-1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
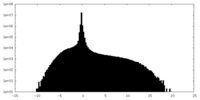
| 密度ヒストグラム |
-追加マップ: 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3,...
| ファイル | emd_24405_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3, 1 mM L-Asp Dataset A, Class A1-4 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
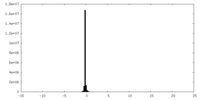
| 密度ヒストグラム |
-追加マップ: 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3,...
| ファイル | emd_24405_additional_4.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 20 mM HEPES/Tris pH 7.4, 250 mM NaNO3, 1 mM L-Asp Dataset A, Class A1-8 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
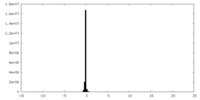
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Complex of glutamate transporter homologue GltPh mutant (S279E/D4...
| 全体 | 名称: Complex of glutamate transporter homologue GltPh mutant (S279E/D405N) with sodium nitrate and aspartate |
|---|---|
| 要素 |
|
-超分子 #1: Complex of glutamate transporter homologue GltPh mutant (S279E/D4...
| 超分子 | 名称: Complex of glutamate transporter homologue GltPh mutant (S279E/D405N) with sodium nitrate and aspartate タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Pyrococcus horikoshii (古細菌) Pyrococcus horikoshii (古細菌) |
-分子 #1: Glutamate transporter homolog
| 分子 | 名称: Glutamate transporter homolog / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Pyrococcus horikoshii (strain ATCC 700860 / DSM 12428 / JCM 9974 / NBRC 100139 / OT-3) (古細菌) Pyrococcus horikoshii (strain ATCC 700860 / DSM 12428 / JCM 9974 / NBRC 100139 / OT-3) (古細菌)株: ATCC 700860 / DSM 12428 / JCM 9974 / NBRC 100139 / OT-3 |
| 分子量 | 理論値: 43.927055 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GLYRKYIEYP VLQKILIGLI LGAIVGLILG HYGYAHAVHT YVKPFGDLFV RLLKMLVMPI VFASLVVGAA SISPARLGRV GVKIVVYYL LTSAFAVTLG IIMARLFNPG AGIHLAVGGQ QFQPHQAPPL VHILLDIVPT NPFGALANGQ VLPTIFFAII L GIAITYLM ...文字列: GLYRKYIEYP VLQKILIGLI LGAIVGLILG HYGYAHAVHT YVKPFGDLFV RLLKMLVMPI VFASLVVGAA SISPARLGRV GVKIVVYYL LTSAFAVTLG IIMARLFNPG AGIHLAVGGQ QFQPHQAPPL VHILLDIVPT NPFGALANGQ VLPTIFFAII L GIAITYLM NSENEKVRKS AETLLDAING LAEAMYKIVN GVMQYAPIGV FALIAYVMAE QGVHVVGELA KVTAAVYVGL TL QILLVYF VLLKIYGIDP ISFIKHAKDA MLTAFVTRSS EGTLPVTMRV AKEMGISEGI YSFTLPLGAT INMDGTALYQ GVC TFFIAN ALGSHLTVGQ QLTIVLTAVL ASIGTAGVPG AGAIMLAMVL HSVGLPLTDP NVAAAYAMIL GIDAILDMGR TMVN VTGNL TGTAIVAKTE UniProtKB: Glutamate transporter homolog |
-分子 #2: ASPARTIC ACID
| 分子 | 名称: ASPARTIC ACID / タイプ: ligand / ID: 2 / コピー数: 3 / 式: ASP |
|---|---|
| 分子量 | 理論値: 133.103 Da |
| Chemical component information |  ChemComp-ASP: |
-分子 #3: SODIUM ION
| 分子 | 名称: SODIUM ION / タイプ: ligand / ID: 3 / コピー数: 6 |
|---|---|
| 分子量 | 理論値: 22.99 Da |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 57 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 糖包埋 | 材質: ice | ||||||||||
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 47.91 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: C3 (3回回転対称) / 解像度のタイプ: BY AUTHOR / 解像度: 2.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 503427 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
 ムービー
ムービー コントローラー
コントローラー





 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)