+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-2403 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Human C3bBb convertase bound to a fragment of Properdin | |||||||||
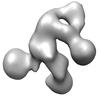
 マップデータ マップデータ | Structure of Human C3bBb convertase bound to a fragment of Properdin | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | properdin / C3b / AP C3 convertase / complement / electron microscopy / EM | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoplasmic side of Golgi membrane / alternative-complement-pathway C3/C5 convertase / positive regulation of opsonization / Defective B3GALTL causes PpS / O-glycosylation of TSR domain-containing proteins / C5L2 anaphylatoxin chemotactic receptor binding / oviduct epithelium development / regulation of triglyceride biosynthetic process / complement binding / positive regulation of activation of membrane attack complex ...cytoplasmic side of Golgi membrane / alternative-complement-pathway C3/C5 convertase / positive regulation of opsonization / Defective B3GALTL causes PpS / O-glycosylation of TSR domain-containing proteins / C5L2 anaphylatoxin chemotactic receptor binding / oviduct epithelium development / regulation of triglyceride biosynthetic process / complement binding / positive regulation of activation of membrane attack complex / negative regulation of endopeptidase activity / vertebrate eye-specific patterning / positive regulation of apoptotic cell clearance / regulation of complement activation / complement-mediated synapse pruning / Alternative complement activation / Activation of C3 and C5 / positive regulation of phagocytosis, engulfment / positive regulation of lipid storage / positive regulation of G protein-coupled receptor signaling pathway / positive regulation of type IIa hypersensitivity / complement receptor mediated signaling pathway / complement-dependent cytotoxicity / positive regulation of D-glucose transmembrane transport / complement activation / complement activation, alternative pathway / endopeptidase inhibitor activity / neuron remodeling / amyloid-beta clearance / B cell activation / positive regulation of vascular endothelial growth factor production / complement activation, classical pathway / Purinergic signaling in leishmaniasis infection / positive regulation of phagocytosis / Peptide ligand-binding receptors / Regulation of Complement cascade / Post-translational protein phosphorylation / response to bacterium / fatty acid metabolic process / positive regulation of immune response / positive regulation of receptor-mediated endocytosis / specific granule lumen / Regulation of Insulin-like Growth Factor (IGF) transport and uptake by Insulin-like Growth Factor Binding Proteins (IGFBPs) / positive regulation of protein phosphorylation / positive regulation of angiogenesis / Immunoregulatory interactions between a Lymphoid and a non-Lymphoid cell / azurophil granule lumen / tertiary granule lumen / secretory granule lumen / G alpha (i) signalling events / blood microparticle / defense response to bacterium / immune response / G protein-coupled receptor signaling pathway / receptor ligand activity / endoplasmic reticulum lumen / inflammatory response / signaling receptor binding / serine-type endopeptidase activity / Neutrophil degranulation / cell surface / signal transduction / protein-containing complex / proteolysis / extracellular space / extracellular exosome / extracellular region / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 29.3 Å | |||||||||
 データ登録者 データ登録者 | Alcorlo M / Tortajada A / Rodriguez de Cordoba S / Llorca O | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2013 ジャーナル: Proc Natl Acad Sci U S A / 年: 2013タイトル: Structural basis for the stabilization of the complement alternative pathway C3 convertase by properdin. 著者: Martín Alcorlo / Agustín Tortajada / Santiago Rodríguez de Córdoba / Oscar Llorca /  要旨: Complement is an essential component of innate immunity. Its activation results in the assembly of unstable protease complexes, denominated C3/C5 convertases, leading to inflammation and lysis. ...Complement is an essential component of innate immunity. Its activation results in the assembly of unstable protease complexes, denominated C3/C5 convertases, leading to inflammation and lysis. Regulatory proteins inactivate C3/C5 convertases on host surfaces to avoid collateral tissue damage. On pathogen surfaces, properdin stabilizes C3/C5 convertases to efficiently fight infection. How properdin performs this function is, however, unclear. Using electron microscopy we show that the N- and C-terminal ends of adjacent monomers in properdin oligomers conform a curly vertex that holds together the AP convertase, interacting with both the C345C and vWA domains of C3b and Bb, respectively. Properdin also promotes a large displacement of the TED (thioester-containing domain) and CUB (complement protein subcomponents C1r/C1s, urchin embryonic growth factor and bone morphogenetic protein 1) domains of C3b, which likely impairs C3-convertase inactivation by regulatory proteins. The combined effect of molecular cross-linking and structural reorganization increases stability of the C3 convertase and facilitates recruitment of fluid-phase C3 convertase to the cell surfaces. Our model explains how properdin mediates the assembly of stabilized C3/C5-convertase clusters, which helps to localize complement amplification to pathogen surfaces. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_2403.map.gz emd_2403.map.gz | 418 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-2403-v30.xml emd-2403-v30.xml emd-2403.xml emd-2403.xml | 17 KB 17 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_2403.jpg emd_2403.jpg | 83.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2403 http://ftp.pdbj.org/pub/emdb/structures/EMD-2403 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2403 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2403 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_2403.map.gz / 形式: CCP4 / 大きさ: 825.2 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_2403.map.gz / 形式: CCP4 / 大きさ: 825.2 KB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Structure of Human C3bBb convertase bound to a fragment of Properdin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 5.68 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Structure of Human C3bBb convertase bound to a fragment of Properdin
| 全体 | 名称: Structure of Human C3bBb convertase bound to a fragment of Properdin |
|---|---|
| 要素 |
|
-超分子 #1000: Structure of Human C3bBb convertase bound to a fragment of Properdin
| 超分子 | 名称: Structure of Human C3bBb convertase bound to a fragment of Properdin タイプ: sample / ID: 1000 詳細: The structure corresponds to Human C3bBb convertase bound to a Properdin vertex Number unique components: 3 |
|---|---|
| 分子量 | 理論値: 285 KDa |
-分子 #1: Fragment Bb from Complement factor B
| 分子 | 名称: Fragment Bb from Complement factor B / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Bb / 詳細: Fragment Bb from factor B / コピー数: 1 / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 組織: plasma Homo sapiens (ヒト) / 別称: Human / 組織: plasma |
| 分子量 | 理論値: 60 KDa |
| 配列 | UniProtKB: Complement factor B GO: extracellular region, plasma membrane, complement binding, serine-type endopeptidase activity, complement activation, alternative pathway, proteolysis, regulation of complement activation InterPro: Complement B/C2, Serine proteases, trypsin domain, Serine proteases, trypsin family, histidine active site, Peptidase S1A, chymotrypsin family, Sushi/SCR/CCP domain, Peptidase S1, PA clan, ...InterPro: Complement B/C2, Serine proteases, trypsin domain, Serine proteases, trypsin family, histidine active site, Peptidase S1A, chymotrypsin family, Sushi/SCR/CCP domain, Peptidase S1, PA clan, von Willebrand factor, type A |
-分子 #2: Fragment C3b from Complement component C3
| 分子 | 名称: Fragment C3b from Complement component C3 / タイプ: protein_or_peptide / ID: 2 / Name.synonym: C3b / コピー数: 1 / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 組織: plasma Homo sapiens (ヒト) / 別称: Human / 組織: plasma |
| 分子量 | 理論値: 180 KDa |
| 配列 | UniProtKB: Complement C3 GO: extracellular space, extracellular exosome, plasma membrane, C5L2 anaphylatoxin chemotactic receptor binding, endopeptidase inhibitor activity, complement activation, alternative pathway, ...GO: extracellular space, extracellular exosome, plasma membrane, C5L2 anaphylatoxin chemotactic receptor binding, endopeptidase inhibitor activity, complement activation, alternative pathway, complement activation, classical pathway, fatty acid metabolic process, G protein-coupled receptor signaling pathway, inflammatory response, negative regulation of endopeptidase activity, positive regulation of activation of membrane attack complex, positive regulation of angiogenesis, positive regulation of G protein-coupled receptor signaling pathway, positive regulation of D-glucose transmembrane transport, positive regulation of lipid storage, positive regulation of phagocytosis, positive regulation of protein phosphorylation, positive regulation of type IIa hypersensitivity, positive regulation of vascular endothelial growth factor production, regulation of complement activation, regulation of triglyceride biosynthetic process InterPro: Alpha-macroglobulin, receptor-binding, Alpha-macroglobulin-like, TED domain, Macroglobulin domain, Alpha-2-macroglobulin, bait region domain, Anaphylatoxin/fibulin, Anaphylatoxin, ...InterPro: Alpha-macroglobulin, receptor-binding, Alpha-macroglobulin-like, TED domain, Macroglobulin domain, Alpha-2-macroglobulin, bait region domain, Anaphylatoxin/fibulin, Anaphylatoxin, complement system, Anaphylatoxin, complement system domain, Alpha-2-macroglobulin, Alpha-2-macroglobulin, conserved site, INTERPRO: IPR019565, Netrin domain, Netrin module, non-TIMP type, Terpenoid cyclases/protein prenyltransferase alpha-alpha toroid, Tissue inhibitor of metalloproteinases-like, OB-fold |
-分子 #3: Complement Factor P
| 分子 | 名称: Complement Factor P / タイプ: protein_or_peptide / ID: 3 / Name.synonym: Properdin / コピー数: 2 / 集合状態: Dimer / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human / 組織: plasma Homo sapiens (ヒト) / 別称: Human / 組織: plasma |
| 分子量 | 理論値: 30 KDa |
| 配列 | UniProtKB: Properdin GO: extracellular space, complement activation, alternative pathway, defense response to bacterium, regulation of complement activation InterPro: Thrombospondin type-1 (TSP1) repeat |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.01 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: 20 mM Hepes, 75 mM NaCl and 5 mM MgCl2 |
| 染色 | タイプ: NEGATIVE 詳細: Grids with adsorbed protein floated on 1% w/v uranyl acetate for 15 seconds |
| グリッド | 詳細: 400 mesh copper carbon only (50ct), glow discharged |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 1230 |
|---|---|
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected using a CMOS camera and the power spectrum |
| 詳細 | Micrographs were recorded using a low-dose protocol under control of the EM-TOOLS software (TVIPS) |
| 日付 | 2012年7月17日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F416 (4k x 4k) デジタル化 - サンプリング間隔: 2.84 µm / 実像数: 1024 / 平均電子線量: 10 e/Å2 詳細: Micrographs were recorded using a low-dose protocol under control of the EM-TOOLS software (TVIPS) and 4 k x 4 k TVIPS CMOS detector (TemCam-F416) ビット/ピクセル: 16 |
| Tilt angle min | 0 |
| 電子線 | 加速電圧: 100 kV / 電子線源: TUNGSTEN HAIRPIN |
| 電子光学系 | 倍率(補正後): 54926 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.9 mm / 最大 デフォーカス(公称値): 1.8 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 40000 |
| 試料ステージ | 試料ホルダーモデル: JEOL / Tilt angle max: 40 |
- 画像解析
画像解析
| 詳細 | The particles were manually selected using Boxer (EMAN1). Images were classified and averaged using maximum-likelihood multi-reference methods as implemented in XMIPP. Ab initio templates for angular refinement were obtained using the random conical tilt (RCT) method performed using XMIPP. 3D reconstructions were obtained using angular refinement as implemented in EMAN. |
|---|---|
| CTF補正 | 詳細: Each frame, estimated with CTFFIND and corrected using BSOFT |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 29.3 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: EMAN1, EMAN2, Xmipp-2.4 / 使用した粒子像数: 12324 |
| 最終 2次元分類 | クラス数: 128 |
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - #0 - Chain ID: H / Chain - #1 - Chain ID: J / Chain - #2 - Chain ID: G |
|---|---|
| ソフトウェア | 名称:  UCSF Chimera UCSF Chimera |
| 詳細 | The domains were separately fitted using UCSF Chimera |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT / 当てはまり具合の基準: Cross correlation |
 ムービー
ムービー コントローラー
コントローラー






























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






















