+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-22401 | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Rubisco at apo state | ||||||||||||||||||||||||||||||
 マップデータ マップデータ | Rubisco at apo state | ||||||||||||||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||||||||||||||
 キーワード キーワード | Rubisco / PLANT PROTEIN / Pyrenoid | ||||||||||||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報photorespiration / ribulose-bisphosphate carboxylase / ribulose-bisphosphate carboxylase activity / reductive pentose-phosphate cycle / chloroplast stroma / chloroplast / monooxygenase activity / magnesium ion binding 類似検索 - 分子機能 | ||||||||||||||||||||||||||||||
| 生物種 |  | ||||||||||||||||||||||||||||||
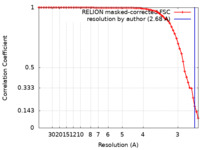
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.68 Å | ||||||||||||||||||||||||||||||
 データ登録者 データ登録者 | Chou H / Matthies D / He S / Jonikas MC / Yu Z | ||||||||||||||||||||||||||||||
| 資金援助 |  米国, 米国,  シンガポール, シンガポール,  英国, 9件 英国, 9件
| ||||||||||||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Plants / 年: 2020 ジャーナル: Nat Plants / 年: 2020タイトル: The structural basis of Rubisco phase separation in the pyrenoid. 著者: Shan He / Hui-Ting Chou / Doreen Matthies / Tobias Wunder / Moritz T Meyer / Nicky Atkinson / Antonio Martinez-Sanchez / Philip D Jeffrey / Sarah A Port / Weronika Patena / Guanhua He / ...著者: Shan He / Hui-Ting Chou / Doreen Matthies / Tobias Wunder / Moritz T Meyer / Nicky Atkinson / Antonio Martinez-Sanchez / Philip D Jeffrey / Sarah A Port / Weronika Patena / Guanhua He / Vivian K Chen / Frederick M Hughson / Alistair J McCormick / Oliver Mueller-Cajar / Benjamin D Engel / Zhiheng Yu / Martin C Jonikas /     要旨: Approximately one-third of global CO fixation occurs in a phase-separated algal organelle called the pyrenoid. The existing data suggest that the pyrenoid forms by the phase separation of the CO- ...Approximately one-third of global CO fixation occurs in a phase-separated algal organelle called the pyrenoid. The existing data suggest that the pyrenoid forms by the phase separation of the CO-fixing enzyme Rubisco with a linker protein; however, the molecular interactions underlying this phase separation remain unknown. Here we present the structural basis of the interactions between Rubisco and its intrinsically disordered linker protein Essential Pyrenoid Component 1 (EPYC1) in the model alga Chlamydomonas reinhardtii. We find that EPYC1 consists of five evenly spaced Rubisco-binding regions that share sequence similarity. Single-particle cryo-electron microscopy of these regions in complex with Rubisco indicates that each Rubisco holoenzyme has eight binding sites for EPYC1, one on each Rubisco small subunit. Interface mutations disrupt binding, phase separation and pyrenoid formation. Cryo-electron tomography supports a model in which EPYC1 and Rubisco form a codependent multivalent network of specific low-affinity bonds, giving the matrix liquid-like properties. Our results advance the structural and functional understanding of the phase separation underlying the pyrenoid, an organelle that plays a fundamental role in the global carbon cycle. | ||||||||||||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_22401.map.gz emd_22401.map.gz | 17.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-22401-v30.xml emd-22401-v30.xml emd-22401.xml emd-22401.xml | 16.6 KB 16.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_22401_fsc.xml emd_22401_fsc.xml | 6.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_22401.png emd_22401.png | 91.6 KB | ||
| Filedesc metadata |  emd-22401.cif.gz emd-22401.cif.gz | 6.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-22401 http://ftp.pdbj.org/pub/emdb/structures/EMD-22401 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22401 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-22401 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_22401_validation.pdf.gz emd_22401_validation.pdf.gz | 506.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_22401_full_validation.pdf.gz emd_22401_full_validation.pdf.gz | 505.8 KB | 表示 | |
| XML形式データ |  emd_22401_validation.xml.gz emd_22401_validation.xml.gz | 9.4 KB | 表示 | |
| CIF形式データ |  emd_22401_validation.cif.gz emd_22401_validation.cif.gz | 12.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22401 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22401 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22401 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-22401 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7jn4MC  7jfoC  7jsxC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10503 (タイトル: CryoEM structure of Rubisco in the apo state / Data size: 895.3 EMPIAR-10503 (タイトル: CryoEM structure of Rubisco in the apo state / Data size: 895.3 Data #1: Unaligned multuframe micrographs of Rubisco in the apo state [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_22401.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_22401.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Rubisco at apo state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.31 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Rubisco at apo state
| 全体 | 名称: Rubisco at apo state |
|---|---|
| 要素 |
|
-超分子 #1: Rubisco at apo state
| 超分子 | 名称: Rubisco at apo state / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  株: CC-2677 cw15 nit1-305 mt-5D |
-分子 #1: Ribulose bisphosphate carboxylase large chain
| 分子 | 名称: Ribulose bisphosphate carboxylase large chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO / EC番号: ribulose-bisphosphate carboxylase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 52.607812 KDa |
| 配列 | 文字列: MVPQTETKAG AGFKAGVKDY RLTYYTPDYV VRDTDILAAF RMTPQPGVPP EECGAAVAAE SSTGTWTTVW TDGLTSLDRY KGRCYDIEP VPGEDNQYIA YVAYPIDLFE EGSVTNMFTS IVGNVFGFKA LRALRLEDLR IPPAYVKTFV GPPHGIQVER D KLNKYGRG ...文字列: MVPQTETKAG AGFKAGVKDY RLTYYTPDYV VRDTDILAAF RMTPQPGVPP EECGAAVAAE SSTGTWTTVW TDGLTSLDRY KGRCYDIEP VPGEDNQYIA YVAYPIDLFE EGSVTNMFTS IVGNVFGFKA LRALRLEDLR IPPAYVKTFV GPPHGIQVER D KLNKYGRG LLGCTIKPKL GLSAKNYGRA VYECLRGGLD FTKDDENVNS QPFMRWRDRF LFVAEAIYKA QAETGEVKGH YL NATAGTC EEMMKRAV(SMC)A KELGVPIIMH DYLTGGFTAN TSLAIYCRDN GLLLHIHRAM HAVIDRQRNH GIHFRVLAK ALRMSGGDHL HSGTVVGKLE GEREVTLGFV DLMRDDYVEK DRSRGIYFTQ DWCSMPGVMP VASGGIHVWH MPALVEIFGD DACLQFGGG TLGHPWGNAP GAAANRVALE ACTQARNEGR DLAREGGDVI RSACKWSPEL AAACEVWKEI KFEFDTIDKL UniProtKB: Ribulose bisphosphate carboxylase large chain |
-分子 #2: Ribulose bisphosphate carboxylase small chain 2, chloroplastic
| 分子 | 名称: Ribulose bisphosphate carboxylase small chain 2, chloroplastic タイプ: protein_or_peptide / ID: 2 / コピー数: 8 / 光学異性体: LEVO / EC番号: ribulose-bisphosphate carboxylase |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 20.667959 KDa |
| 配列 | 文字列: MAAVIAKSSV SAAVARPARS SVRPMAALKP AVKAAPVAAP AQANQMMVWT PVNNKMFETF SYLPPLSDEQ IAAQVDYIVA NGWIPCLEF AESDKAYVSN ESAIRFGSVS CLYYDNRYWT MWKLPMFGCR DPMQVLREIV ACTKAFPDAY VRLVAFDNQK Q VQIMGFLV QRPKSARDWQ PANKRSV UniProtKB: Ribulose bisphosphate carboxylase small subunit, chloroplastic 2 |
-分子 #3: water
| 分子 | 名称: water / タイプ: ligand / ID: 3 / コピー数: 232 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 6.8 詳細: 200 mM sorbitol, 50 mM HEPES, 50 mM KOAc, 2 mM Mg(OAc)2.4H2O and 1 mM CaCl2 |
|---|---|
| グリッド | モデル: Quantifoil / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. 詳細: glow discharging for 60 seconds with a current of 15 mA in a Pelico EasiGlow system |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - サイズ - 横: 7676 pixel / デジタル化 - サイズ - 縦: 7462 pixel / デジタル化 - 画像ごとのフレーム数: 1-60 / 実像数: 1834 / 平均露光時間: 10.0 sec. / 平均電子線量: 58.2 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 倍率(公称値): 22500 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)