+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-20084 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | The Central Role of the Tail in Switching Off Myosin II in Cells | ||||||||||||
 マップデータ マップデータ | 3D reconstruction of smooth muscle myosin II molecule in the inhibited state | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Smooth Muscle / MyosinII / 10S / single particle analysis / CONTRACTILE PROTEIN | ||||||||||||
| 生物種 |  | ||||||||||||
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 25.0 Å | ||||||||||||
 データ登録者 データ登録者 | Craig R / Yang SX / Lee KH / Woodhead JL / Sato O / Ikebe M | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: J Gen Physiol / 年: 2019 ジャーナル: J Gen Physiol / 年: 2019タイトル: The central role of the tail in switching off 10S myosin II activity. 著者: Shixin Yang / Kyoung Hwan Lee / John L Woodhead / Osamu Sato / Mitsuo Ikebe / Roger Craig /  要旨: Myosin II is a motor protein with two heads and an extended tail that plays an essential role in cell motility. Its active form is a polymer (myosin filament) that pulls on actin to generate motion. ...Myosin II is a motor protein with two heads and an extended tail that plays an essential role in cell motility. Its active form is a polymer (myosin filament) that pulls on actin to generate motion. Its inactive form is a monomer with a compact structure (10S sedimentation coefficient), in which the tail is folded and the two heads interact with each other, inhibiting activity. This conformation is thought to function in cells as an energy-conserving form of the molecule suitable for storage as well as transport to sites of filament assembly. The mechanism of inhibition of the compact molecule is not fully understood. We have performed a 3-D reconstruction of negatively stained 10S myosin from smooth muscle in the inhibited state using single-particle analysis. The reconstruction reveals multiple interactions between the tail and the two heads that appear to trap ATP hydrolysis products, block actin binding, hinder head phosphorylation, and prevent filament formation. Blocking these essential features of myosin function could explain the high degree of inhibition of the folded form of myosin thought to underlie its energy-conserving function in cells. The reconstruction also suggests a mechanism for unfolding when myosin is activated by phosphorylation. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_20084.map.gz emd_20084.map.gz | 9.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-20084-v30.xml emd-20084-v30.xml emd-20084.xml emd-20084.xml | 10.9 KB 10.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_20084.png emd_20084.png | 58.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-20084 http://ftp.pdbj.org/pub/emdb/structures/EMD-20084 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20084 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-20084 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_20084_validation.pdf.gz emd_20084_validation.pdf.gz | 436.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_20084_full_validation.pdf.gz emd_20084_full_validation.pdf.gz | 436.4 KB | 表示 | |
| XML形式データ |  emd_20084_validation.xml.gz emd_20084_validation.xml.gz | 5.4 KB | 表示 | |
| CIF形式データ |  emd_20084_validation.cif.gz emd_20084_validation.cif.gz | 6.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20084 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20084 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20084 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-20084 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_20084.map.gz / 形式: CCP4 / 大きさ: 12.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_20084.map.gz / 形式: CCP4 / 大きさ: 12.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D reconstruction of smooth muscle myosin II molecule in the inhibited state | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.7 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Myosin II
| 全体 | 名称: Myosin II |
|---|---|
| 要素 |
|
-超分子 #1: Myosin II
| 超分子 | 名称: Myosin II / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Myosin II
| 分子 | 名称: Myosin II / タイプ: other / ID: 1 / 分類: other |
|---|---|
| 由来(天然) | 生物種:  |
| 配列 | 文字列: MSQKPLSDDE KFLFVDKNFV NNPLAQADWS AKKLVWVPSE KHGFEAASIK EEKGDEVTVE LQENGKKVT LSKDDIQKMN PPKFSKVEDM AELTCLNEAS VLHNLRERYF SGLIYTYSGL F CVVINPYK QLPIYSEKII DMYKGKKRHE MPPHIYAIAD TAYRSMLQDR ...文字列: MSQKPLSDDE KFLFVDKNFV NNPLAQADWS AKKLVWVPSE KHGFEAASIK EEKGDEVTVE LQENGKKVT LSKDDIQKMN PPKFSKVEDM AELTCLNEAS VLHNLRERYF SGLIYTYSGL F CVVINPYK QLPIYSEKII DMYKGKKRHE MPPHIYAIAD TAYRSMLQDR EDQSILCTGE SG AGKTENT KKVIQYLAVV ASSHKGKKDT SITQGPSFSY GELEKQLLQA NPILEAFGNA KTV KNDNSS RFGKFIRINF DVTGYIVGAN IETYLLEKSR AIRQAKDERT FHIFYYLIAG ASEQ MRNDL LLEGFNNYTF LSNGHVPIPA QQDDEMFQET LEAMTIMGFT EEEQTSILRV VSSVL QLGN IVFKKERNTD QASMPDNTAA QKVCHLMGIN VTDFTRSILT PRIKVGRDVV QKAQTK EQA DFAIEALAKA KFERLFRWIL TRVNKALDKT KRQGASFLGI LDIAGFEIFE INSFEQL CI NYTNEKLQQL FNHTMFILEQ EEYQREGIEW NFIDFGLDLQ PCIELIERPT NPPGVLAL L DEECWFPKAT DTSFVEKLIQ EQGNHAKFQK SKQLKDKTEF CILHYAGKVT YNASAWLTK NMDPLNDNVT SLLNQSSDKF VADLWKDVDR IVGLDQMAKM TESSLPSASK TKKGMFRTVG QLYKEQLTK LMTTLRNTNP NFVRCIIPNH EKRAGKLDAH LVLEQLRCNG VLEGIRICRQ G FPNRIVFQ EFRQRYEILA ANAIPKGFMD GKQACILMIK ALELDPNLYR IGQSKIFFRT GV LAHLEEE RDLKITDVII AFQAQCRGYL ARKAFAKRQQ QLTAMKVIQR NCAAYLKLRN WQW WRLFTK VKPLLQVTRQ EEEMQAKDEE LQRTKERQQK AEAELKELEQ KHTQLCEEKN LLQE KLQAE TELYAEAEEM RVRLAAKKQE LEEILHEMEA RIEEEEERSQ QLQAEKKKMQ QQMLD LEEQ LEEEEAARQK LQLEKVTADG KIKKMEDDIL IMEDQNNKLT KERKLLEERV SDLTTN LAE EEEKAKNLTK LKNKHESMIS ELEVRLKKEE KSRQELEKIK RKLEGESSDL HEQIAEL QA QIAELKAQLA KKEEELQAAL ARLEDETSQK NNALKKIREL ESHISDLQED LESEKAAR N KAEKQKRDLS EELEALKTEL EDTLDTTATQ QELRAKREQE VTVLKRALEE ETRTHEAQV QEMRQKHTQA VEELTEQLEQ FKRAKANLDK TKQTLEKDNA DLANEIRSLS QAKQDVEHKK KKLEVQLQD LQSKYSDGER VRTELNEKVH KLQIEVENVT SLLNEAESKN IKLTKDVATL G SQLQDTQE LLQEETRQKL NVTTKLRQLE DDKNSLQEQL DEEVEAKQNL ERHISTLTIQ LS DSKKKLQ EFTATVETME EGKKKLQREI ESLTQQFEEK AASYDKLEKT KNRLQQELDD LVV DLDNQR QLVSNLEKKQ KKFDQMLAEE KNISSKYADE RDRAEAEARE KETKALSLAR ALEE ALEAK EELERTNKML KAEMEDLVSS KDDVGKNVHE LEKSKRTLEQ QVEEMKTQLE ELEDE LQAA EDAKLRLEVN MQAMKSQFER DLQARDEQNE EKRRQLLKQL HEHETELEDE RKQRAL AAA AKKKLEVDVK DLESQVDSAN KAREEAIKQL RKLQAQMKDY QRDLDDARAA REEIFAT AR ENEKKAKNLE AELIQLQEDL AAAERARKQA DLEKEEMAEE LASANSGRTS LQDEKRRL E ARIAQLEEEL DEEHSNIETM SDRMRKAVQQ AEQLNNELAT ERATAQKNEN ARQQLERQN KELRSKLQEM EGAVKSKFKS TIAALEAKIA SLEEQLEQEA REKQAAAKTL RQKDKKLKDA LLQVEDERK QAEQYKDQAE KGNLRLKQLK RQLEEAEEES QRINANRRKL QRELDEATES N DALGREVA ALKSKLRRGN EPVSFAPPRR SGGRRVIENA TDGGEEEIDG RDGDFNGKAS E |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 染色 | タイプ: NEGATIVE / 材質: uranyl acetate |
| グリッド | 詳細: unspecified |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM120T |
|---|---|
| 撮影 | フィルム・検出器のモデル: TVIPS TEMCAM-F224 (2k x 2k) 平均電子線量: 20.0 e/Å2 |
| 電子線 | 加速電圧: 120 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: RANDOM CONICAL TILT |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 25.0 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 15833 |
| 初期 角度割当 | タイプ: OTHER |
| 最終 角度割当 | タイプ: PROJECTION MATCHING |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera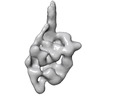





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















