+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of tetrameric human SAMHD1 State V - Depleted relaxed | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | TRIPHOSPHOHYDROLASE / METALLO-ENZYME / BINUCLEAR / HD / HYDROLASE | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Nucleotide catabolism / 加水分解酵素; エステル加水分解酵素; 三リン酸モノエステル加水分解酵素 / deoxynucleoside triphosphate hydrolase activity / dGTP binding / dATP catabolic process / deoxyribonucleotide catabolic process / tetraspanin-enriched microdomain / dGTPase activity / dGTP catabolic process / DNA strand resection involved in replication fork processing ...Nucleotide catabolism / 加水分解酵素; エステル加水分解酵素; 三リン酸モノエステル加水分解酵素 / deoxynucleoside triphosphate hydrolase activity / dGTP binding / dATP catabolic process / deoxyribonucleotide catabolic process / tetraspanin-enriched microdomain / dGTPase activity / dGTP catabolic process / DNA strand resection involved in replication fork processing / negative regulation of type I interferon-mediated signaling pathway / regulation of innate immune response / RNA nuclease activity / somatic hypermutation of immunoglobulin genes / double-strand break repair via homologous recombination / Interferon alpha/beta signaling / site of double-strand break / single-stranded DNA binding / protein homotetramerization / defense response to virus / nucleic acid binding / immune response / innate immune response / DNA damage response / GTP binding / RNA binding / zinc ion binding / nucleoplasm / identical protein binding / nucleus / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.43 Å | ||||||||||||
 データ登録者 データ登録者 | Acton OJ / Sheppard D / Rosenthal PB / Taylor IA | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Platform-directed allostery and quaternary structure dynamics of SAMHD1 catalysis. 著者: Oliver J Acton / Devon Sheppard / Simone Kunzelmann / Sarah J Caswell / Andrea Nans / Ailidh J O Burgess / Geoff Kelly / Elizabeth R Morris / Peter B Rosenthal / Ian A Taylor /  要旨: SAMHD1 regulates cellular nucleotide homeostasis, controlling dNTP levels by catalysing their hydrolysis into 2'-deoxynucleosides and triphosphate. In differentiated CD4+ macrophage and resting T- ...SAMHD1 regulates cellular nucleotide homeostasis, controlling dNTP levels by catalysing their hydrolysis into 2'-deoxynucleosides and triphosphate. In differentiated CD4+ macrophage and resting T-cells SAMHD1 activity results in the inhibition of HIV-1 infection through a dNTP blockade. In cancer, SAMHD1 desensitizes cells to nucleoside-analogue chemotherapies. Here we employ time-resolved cryogenic-EM imaging and single-particle analysis to visualise assembly, allostery and catalysis by this multi-subunit enzyme. Our observations reveal how dynamic conformational changes in the SAMHD1 quaternary structure drive the catalytic cycle. We capture five states at high-resolution in a live catalytic reaction, revealing how allosteric activators support assembly of a stable SAMHD1 tetrameric core and how catalysis is driven by the opening and closing of active sites through pairwise coupling of active sites and order-disorder transitions in regulatory domains. This direct visualisation of enzyme catalysis dynamics within an allostery-stabilised platform sets a precedent for mechanistic studies into the regulation of multi-subunit enzymes. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_18734.map.gz emd_18734.map.gz | 2.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-18734-v30.xml emd-18734-v30.xml emd-18734.xml emd-18734.xml | 16.1 KB 16.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_18734_fsc.xml emd_18734_fsc.xml | 10.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_18734.png emd_18734.png | 79.7 KB | ||
| Filedesc metadata |  emd-18734.cif.gz emd-18734.cif.gz | 6 KB | ||
| その他 |  emd_18734_half_map_1.map.gz emd_18734_half_map_1.map.gz emd_18734_half_map_2.map.gz emd_18734_half_map_2.map.gz | 95.6 MB 95.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-18734 http://ftp.pdbj.org/pub/emdb/structures/EMD-18734 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18734 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18734 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_18734_validation.pdf.gz emd_18734_validation.pdf.gz | 858.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_18734_full_validation.pdf.gz emd_18734_full_validation.pdf.gz | 857.8 KB | 表示 | |
| XML形式データ |  emd_18734_validation.xml.gz emd_18734_validation.xml.gz | 18.3 KB | 表示 | |
| CIF形式データ |  emd_18734_validation.cif.gz emd_18734_validation.cif.gz | 23.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18734 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18734 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18734 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18734 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_18734.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_18734.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.09 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_18734_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
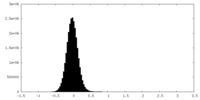
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_18734_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : homotetramer of SAMHD1
| 全体 | 名称: homotetramer of SAMHD1 |
|---|---|
| 要素 |
|
-超分子 #1: homotetramer of SAMHD1
| 超分子 | 名称: homotetramer of SAMHD1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Deoxynucleoside triphosphate triphosphohydrolase SAMHD1
| 分子 | 名称: Deoxynucleoside triphosphate triphosphohydrolase SAMHD1 タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 72.305414 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MQRADSEQPS KRPRCDDSPR TPSNTPSAEA DWSPGLELHP DYKTWGPEQV CSFLRRGGFE EPVLLKNIRE NEITGALLPC LDESRFENL GVSSLGERKK LLSYIQRLVQ IHVDTMKVIN DPIHGHIELH PLLVRIIDTP QFQRLRYIKQ LGGGYYVFPG A SHNRFEHS ...文字列: MQRADSEQPS KRPRCDDSPR TPSNTPSAEA DWSPGLELHP DYKTWGPEQV CSFLRRGGFE EPVLLKNIRE NEITGALLPC LDESRFENL GVSSLGERKK LLSYIQRLVQ IHVDTMKVIN DPIHGHIELH PLLVRIIDTP QFQRLRYIKQ LGGGYYVFPG A SHNRFEHS LGVGYLAGCL VHALGEKQPE LQISERDVLC VQIAGLCHDL GHGPFSHMFD GRFIPLARPE VKWTHEQGSV MM FEHLINS NGIKPVMEQY GLIPEEDICF IKEQIVGPLE SPVEDSLWPY KGRPENKSFL YEIVSNKRNG IDVDKWDYFA RDC HHLGIQ NNFDYKRFIK FARVCEVDNE LRICARDKEV GNLYDMFHTR NSLHRRAYQH KVGNIIDTMI TDAFLKADDY IEIT GAGGK KYRISTAIDD MEAYTKLTDN IFLEILYSTD PKLKDAREIL KQIEYRNLFK YVGETQPTGQ IKIKREDYES LPKEV ASAK PKVLLDVKLK AEDFIVDVIN MDYGMQEKNP IDHVSFYCKT APNRAIRITK NQVSQLLPEK FAEQLIRVYC KKVDRK SLY AARQYFVQWC ADRNFTKPQD GDVIAPLITP QKKEWNDSTS VQNPTRLREA SKSRVQLFKD DPM UniProtKB: Deoxynucleoside triphosphate triphosphohydrolase SAMHD1 |
-分子 #2: GUANOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 4 / 式: GTP |
|---|---|
| 分子量 | 理論値: 523.18 Da |
| Chemical component information |  ChemComp-GTP: |
-分子 #3: FE (III) ION
| 分子 | 名称: FE (III) ION / タイプ: ligand / ID: 3 / コピー数: 4 / 式: FE |
|---|---|
| 分子量 | 理論値: 55.845 Da |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #5: 2'-DEOXYADENOSINE 5'-TRIPHOSPHATE
| 分子 | 名称: 2'-DEOXYADENOSINE 5'-TRIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 2 / 式: DTP |
|---|---|
| 分子量 | 理論値: 491.182 Da |
| Chemical component information |  ChemComp-DTP: |
-分子 #6: 2'-DEOXYCYTIDINE-5'-TRIPHOSPHATE
| 分子 | 名称: 2'-DEOXYCYTIDINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 6 / コピー数: 2 / 式: DCP |
|---|---|
| 分子量 | 理論値: 467.157 Da |
| Chemical component information |  ChemComp-DCP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 平均電子線量: 33.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源: LAB6 |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 75000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-8qxo: |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)