+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | ASCT2 protomer in lipid nanodiscs with bound glutamine and Na+ ions in the outward-facing state (OFS.1) | |||||||||
 マップデータ マップデータ | Sharpened map of ASCT2 protomer in 2N2 with Na ions and gln in OFS.1 with Phenix | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | neutral amino acid exchanger amino acid transport system elevator transporter glutamine transport / TRANSPORT PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報glutamine secretion / L-glutamine import across plasma membrane / L-glutamine transmembrane transporter activity / glutamine transport / L-serine transmembrane transporter activity / ligand-gated channel activity / neutral amino acid transport / L-aspartate transmembrane transporter activity / L-aspartate import across plasma membrane / neutral L-amino acid transmembrane transporter activity ...glutamine secretion / L-glutamine import across plasma membrane / L-glutamine transmembrane transporter activity / glutamine transport / L-serine transmembrane transporter activity / ligand-gated channel activity / neutral amino acid transport / L-aspartate transmembrane transporter activity / L-aspartate import across plasma membrane / neutral L-amino acid transmembrane transporter activity / amino acid transmembrane transporter activity / Amino acid transport across the plasma membrane / symporter activity / antiporter activity / amino acid transport / protein homotrimerization / RHOJ GTPase cycle / RHOQ GTPase cycle / RHOH GTPase cycle / RAC3 GTPase cycle / transport across blood-brain barrier / RAC1 GTPase cycle / erythrocyte differentiation / basal plasma membrane / centriolar satellite / melanosome / signaling receptor activity / virus receptor activity / ciliary basal body / extracellular exosome / metal ion binding / membrane / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
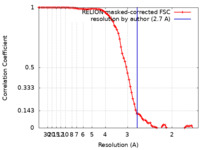
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.7 Å | |||||||||
 データ登録者 データ登録者 | Borowska A / Rheinberger J / Paulino C / Slotboom DJ | |||||||||
| 資金援助 |  オランダ, 2件 オランダ, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Structural basis of the obligatory exchange mode of human neutral amino acid transporter ASCT2. 著者: Anna M Borowska / Maria Gabriella Chiariello / Alisa A Garaeva / Jan Rheinberger / Siewert J Marrink / Cristina Paulino / Dirk J Slotboom /    要旨: ASCT2 is an obligate exchanger of neutral amino acids, contributing to cellular amino acid homeostasis. ASCT2 belongs to the same family (SLC1) as Excitatory Amino Acid Transporters (EAATs) that ...ASCT2 is an obligate exchanger of neutral amino acids, contributing to cellular amino acid homeostasis. ASCT2 belongs to the same family (SLC1) as Excitatory Amino Acid Transporters (EAATs) that concentrate glutamate in the cytosol. The mechanism that makes ASCT2 an exchanger rather than a concentrator remains enigmatic. Here, we employ cryo-electron microscopy and molecular dynamics simulations to elucidate the structural basis of the exchange mechanism of ASCT2. We establish that ASCT2 binds three Na ions per transported substrate and visits a state that likely acts as checkpoint in preventing Na ion leakage, both features shared with EAATs. However, in contrast to EAATs, ASCT2 retains one Na ion even under Na-depleted conditions. We demonstrate that ASCT2 cannot undergo the structural transition in TM7 that is essential for the concentrative transport cycle of EAATs. This structural rigidity and the high-affinity Na binding site effectively confine ASCT2 to an exchange mode. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_18622.map.gz emd_18622.map.gz | 35.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-18622-v30.xml emd-18622-v30.xml emd-18622.xml emd-18622.xml | 24 KB 24 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_18622_fsc.xml emd_18622_fsc.xml | 8.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_18622.png emd_18622.png | 68.1 KB | ||
| マスクデータ |  emd_18622_msk_1.map emd_18622_msk_1.map | 52.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-18622.cif.gz emd-18622.cif.gz | 6.9 KB | ||
| その他 |  emd_18622_additional_1.map.gz emd_18622_additional_1.map.gz emd_18622_half_map_1.map.gz emd_18622_half_map_1.map.gz emd_18622_half_map_2.map.gz emd_18622_half_map_2.map.gz | 40.1 MB 40.7 MB 40.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-18622 http://ftp.pdbj.org/pub/emdb/structures/EMD-18622 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18622 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18622 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8qrpMC  8qroC  8qrqC  8qrrC  8qrsC  8qruC  8qrvC  8qrwC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_18622.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_18622.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened map of ASCT2 protomer in 2N2 with Na ions and gln in OFS.1 with Phenix | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.836 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_18622_msk_1.map emd_18622_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
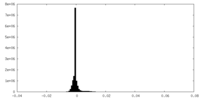
| 密度ヒストグラム |
-追加マップ: Unsharpened map of ASCT2 protomer in 2N2 with...
| ファイル | emd_18622_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map of ASCT2 protomer in 2N2 with Na ions and gln in OFS.1 at 2.7A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
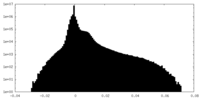
| 密度ヒストグラム |
-ハーフマップ: Half map 1 of ASCT2 protomer in 2N2...
| ファイル | emd_18622_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 of ASCT2 protomer in 2N2 with Na ions and gln in OFS.1 used for refinement and gold-standard FSC resolution calculation | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
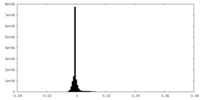
| 密度ヒストグラム |
-ハーフマップ: Half map 2 of ASCT2 protomer in 2N2...
| ファイル | emd_18622_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 of ASCT2 protomer in 2N2 with Na ions and gln in OFS.1 used for refinement and gold-standard FSC resolution calculation | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
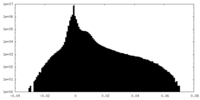
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : ASCT2 in MSP2N2 lipid nanodiscs with glutamine and Na+ ions
| 全体 | 名称: ASCT2 in MSP2N2 lipid nanodiscs with glutamine and Na+ ions |
|---|---|
| 要素 |
|
-超分子 #1: ASCT2 in MSP2N2 lipid nanodiscs with glutamine and Na+ ions
| 超分子 | 名称: ASCT2 in MSP2N2 lipid nanodiscs with glutamine and Na+ ions タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 53.4 KDa |
-分子 #1: Neutral amino acid transporter B(0)
| 分子 | 名称: Neutral amino acid transporter B(0) / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 57.467793 KDa |
| 組換発現 | 生物種:  Komagataella pastoris (菌類) Komagataella pastoris (菌類) |
| 配列 | 文字列: MVADPPRDSK GLAAAEPTAN GGLALASIED QGAAAGGYCG SRDQVRRCLR ANLLVLLTVV AVVAGVALGL GVSGAGGALA LGPERLSAF VFPGELLLRL LRMIILPLVV CSLIGGAASL DPGALGRLGA WALLFFLVTT LLASALGVGL ALALQPGAAS A AINASVGA ...文字列: MVADPPRDSK GLAAAEPTAN GGLALASIED QGAAAGGYCG SRDQVRRCLR ANLLVLLTVV AVVAGVALGL GVSGAGGALA LGPERLSAF VFPGELLLRL LRMIILPLVV CSLIGGAASL DPGALGRLGA WALLFFLVTT LLASALGVGL ALALQPGAAS A AINASVGA AGSAENAPSK EVLDSFLDLA RNIFPSNLVS AAFRSYSTTY EERNITGTRV KVPVGQEVEG MNILGLVVFA IV FGVALRK LGPEGELLIR FFNSFNEATM VLVSWIMWYA PVGIMFLVAG KIVEMEDVGL LFARLGKYIL CCLLGHAIHG LLV LPLIYF LFTRKNPYRF LWGIVTPLAT AFGTSSSSAT LPLMMKCVEE NNGVAKHISR FILPIGATVN MDGAALFQCV AAVF IAQLS QQSLDFVKII TILVTATASS VGAAGIPAGG VLTLAIILEA VNLPVDHISL ILAVDWLVDR SCTVLNVEGD ALGAG LLQN YVDRTESRST EPELIQVKSE LPLDPLPVPT EEGNPLLKHY RGPAGDATVA SEKESVMHHH HHH UniProtKB: Neutral amino acid transporter B(0) |
-分子 #2: SODIUM ION
| 分子 | 名称: SODIUM ION / タイプ: ligand / ID: 2 / コピー数: 3 |
|---|---|
| 分子量 | 理論値: 22.99 Da |
-分子 #3: GLUTAMINE
| 分子 | 名称: GLUTAMINE / タイプ: ligand / ID: 3 / コピー数: 1 / 式: GLN |
|---|---|
| 分子量 | 理論値: 146.144 Da |
| Chemical component information |  ChemComp-GLN: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: 20 mM Tris/HCl pH 7.4, 200 mM NaCl, 1 mM gln |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 詳細: 5 mA |
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 288 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 5 / 実像数: 14117 / 平均露光時間: 2.43 sec. / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 倍率(補正後): 59809 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.9 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)