+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Low-resolution structure of the NorQ chaperone from Paracoccus denitrificans | ||||||||||||
 マップデータ マップデータ | Low-resolution structure of the NorQ chaperone from Paracoccus denitrificans | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | MoxR AAA+ and VWA domain proteins / CHAPERONE | ||||||||||||
| 生物種 |  Paracoccus denitrificans (バクテリア) Paracoccus denitrificans (バクテリア) | ||||||||||||
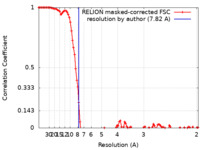
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.82 Å | ||||||||||||
 データ登録者 データ登録者 | Adelroth P / Carroni M / Kahle M / Appelgren S / Elofsson A | ||||||||||||
| 資金援助 |  スウェーデン, 3件 スウェーデン, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: BMC Biol / 年: 2023 ジャーナル: BMC Biol / 年: 2023タイトル: Insights into the structure-function relationship of the NorQ/NorD chaperones from Paracoccus denitrificans reveal shared principles of interacting MoxR AAA+/VWA domain proteins. 著者: Maximilian Kahle / Sofia Appelgren / Arne Elofsson / Marta Carroni / Pia Ädelroth /   要旨: BACKGROUND: NorQ, a member of the MoxR-class of AAA+ ATPases, and NorD, a protein containing a Von Willebrand Factor Type A (VWA) domain, are essential for non-heme iron (Fe) cofactor insertion into ...BACKGROUND: NorQ, a member of the MoxR-class of AAA+ ATPases, and NorD, a protein containing a Von Willebrand Factor Type A (VWA) domain, are essential for non-heme iron (Fe) cofactor insertion into cytochrome c-dependent nitric oxide reductase (cNOR). cNOR catalyzes NO reduction, a key step of bacterial denitrification. This work aimed at elucidating the specific mechanism of NorQD-catalyzed Fe insertion, and the general mechanism of the MoxR/VWA interacting protein families. RESULTS: We show that NorQ-catalyzed ATP hydrolysis, an intact VWA domain in NorD, and specific surface carboxylates on cNOR are all features required for cNOR activation. Supported by BN-PAGE, low- ...RESULTS: We show that NorQ-catalyzed ATP hydrolysis, an intact VWA domain in NorD, and specific surface carboxylates on cNOR are all features required for cNOR activation. Supported by BN-PAGE, low-resolution cryo-EM structures of NorQ and the NorQD complex show that NorQ forms a circular hexamer with a monomer of NorD binding both to the side and to the central pore of the NorQ ring. Guided by AlphaFold predictions, we assign the density that "plugs" the NorQ ring pore to the VWA domain of NorD with a protruding "finger" inserting through the pore and suggest this binding mode to be general for MoxR/VWA couples. CONCLUSIONS: Based on our results, we present a tentative model for the mechanism of NorQD-catalyzed cNOR remodeling and suggest many of its features to be applicable to the whole MoxR/VWA family. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16656.map.gz emd_16656.map.gz | 78.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16656-v30.xml emd-16656-v30.xml emd-16656.xml emd-16656.xml | 14.5 KB 14.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16656_fsc.xml emd_16656_fsc.xml | 10.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16656.png emd_16656.png | 78 KB | ||
| マスクデータ |  emd_16656_msk_1.map emd_16656_msk_1.map | 103 MB |  マスクマップ マスクマップ | |
| その他 |  emd_16656_half_map_1.map.gz emd_16656_half_map_1.map.gz emd_16656_half_map_2.map.gz emd_16656_half_map_2.map.gz | 79.4 MB 79.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16656 http://ftp.pdbj.org/pub/emdb/structures/EMD-16656 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16656 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16656 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16656_validation.pdf.gz emd_16656_validation.pdf.gz | 665.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16656_full_validation.pdf.gz emd_16656_full_validation.pdf.gz | 665.5 KB | 表示 | |
| XML形式データ |  emd_16656_validation.xml.gz emd_16656_validation.xml.gz | 17.8 KB | 表示 | |
| CIF形式データ |  emd_16656_validation.cif.gz emd_16656_validation.cif.gz | 23.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16656 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16656 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16656 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16656 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16656.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16656.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Low-resolution structure of the NorQ chaperone from Paracoccus denitrificans | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.99 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_16656_msk_1.map emd_16656_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Low-resolution structure of the NorQ chaperone from Paracoccus...
| ファイル | emd_16656_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Low-resolution structure of the NorQ chaperone from Paracoccus denitrificans Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Low-resolution structure of the NorQ chaperone from Paracoccus...
| ファイル | emd_16656_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Low-resolution structure of the NorQ chaperone from Paracoccus denitrificans Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : NorQ hexamer
| 全体 | 名称: NorQ hexamer |
|---|---|
| 要素 |
|
-超分子 #1: NorQ hexamer
| 超分子 | 名称: NorQ hexamer / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Paracoccus denitrificans (バクテリア) Paracoccus denitrificans (バクテリア) |
-分子 #1: Pd. NorQ
| 分子 | 名称: Pd. NorQ / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Paracoccus denitrificans (バクテリア) Paracoccus denitrificans (バクテリア) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MHHHHHHASN AHVKTQGNGA VDAPFYLPQG DEVAVFEAAA ANDLPVLLKG PTGCGKTRFV AHMAARLG R PLYTVACHDD LSAADLIGRY LLKGGETVWT DGPLTRAVRE GAICYLDQVV EARKDVTVV LHPLTDDRRI LPIDRTGEEI EAAPGFMLVA SYNPGYQNIL ...文字列: MHHHHHHASN AHVKTQGNGA VDAPFYLPQG DEVAVFEAAA ANDLPVLLKG PTGCGKTRFV AHMAARLG R PLYTVACHDD LSAADLIGRY LLKGGETVWT DGPLTRAVRE GAICYLDQVV EARKDVTVV LHPLTDDRRI LPIDRTGEEI EAAPGFMLVA SYNPGYQNIL KTLKPSTRQR FVAMEFDFPE PAREVEIVA RESGLDRDRT LGLVRLAGKI RGLKGQDLEE GVSTRLVVYA ASLTRRGMNL D RAIEAAMI EPLTDDAEVK RGLRDLAAAI FG |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.6 / 詳細: 20 mM HEPES, 150 mM NaCl, 2 mM DTT |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS TALOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 平均電子線量: 1.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 120000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
 ムービー
ムービー コントローラー
コントローラー





 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)