+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Neurofascin isoform NF155 extracellular domain | |||||||||
 マップデータ マップデータ | Volume map of the NF155 extracellular domain obtained by negative stain EM. | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
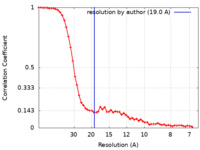
| 手法 | 単粒子再構成法 / ネガティブ染色法 / 解像度: 19.0 Å | |||||||||
 データ登録者 データ登録者 | McKie SJ / Deane JE / Butt BG | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2023 ジャーナル: Proc Natl Acad Sci U S A / 年: 2023タイトル: Altered plasma membrane abundance of the sulfatide-binding protein NF155 links glycosphingolipid imbalances to demyelination. 著者: Shannon J McKie / Alex S Nicholson / Emily Smith / Stuart Fawke / Eve R Caroe / James C Williamson / Benjamin G Butt / Denisa Kolářová / Ondřej Peterka / Michal Holčapek / Paul J Lehner ...著者: Shannon J McKie / Alex S Nicholson / Emily Smith / Stuart Fawke / Eve R Caroe / James C Williamson / Benjamin G Butt / Denisa Kolářová / Ondřej Peterka / Michal Holčapek / Paul J Lehner / Stephen C Graham / Janet E Deane /   要旨: Myelin is a multilayered membrane that tightly wraps neuronal axons, enabling efficient, high-speed signal propagation. The axon and myelin sheath form tight contacts, mediated by specific plasma ...Myelin is a multilayered membrane that tightly wraps neuronal axons, enabling efficient, high-speed signal propagation. The axon and myelin sheath form tight contacts, mediated by specific plasma membrane proteins and lipids, and disruption of these contacts causes devastating demyelinating diseases. Using two cell-based models of demyelinating sphingolipidoses, we demonstrate that altered lipid metabolism changes the abundance of specific plasma membrane proteins. These altered membrane proteins have known roles in cell adhesion and signaling, with several implicated in neurological diseases. The cell surface abundance of the adhesion molecule neurofascin (NFASC), a protein critical for the maintenance of myelin-axon contacts, changes following disruption to sphingolipid metabolism. This provides a direct molecular link between altered lipid abundance and myelin stability. We show that the NFASC isoform NF155, but not NF186, interacts directly and specifically with the sphingolipid sulfatide via multiple binding sites and that this interaction requires the full-length extracellular domain of NF155. We demonstrate that NF155 adopts an S-shaped conformation and preferentially binds sulfatide-containing membranes in , with important implications for protein arrangement in the tight axon-myelin space. Our work links glycosphingolipid imbalances to disturbance of membrane protein abundance and demonstrates how this may be driven by direct protein-lipid interactions, providing a mechanistic framework to understand the pathogenesis of galactosphingolipidoses. #1:  ジャーナル: BioRxiv / 年: 2022 ジャーナル: BioRxiv / 年: 2022タイトル: Altered plasma membrane abundance of the sulfatide-binding protein NF155 links glycosphingolipid imbalances to demyelination 著者: McKie SJ / Deane JE / Nicholson A / Smith E / Fawke S / Caroe E / Williamson JC / Butt BG / Kolarova D / Peterka O / Holcapek M / Lehner PJ / Graham SC | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16540.map.gz emd_16540.map.gz | 6.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16540-v30.xml emd-16540-v30.xml emd-16540.xml emd-16540.xml | 16.3 KB 16.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16540_fsc.xml emd_16540_fsc.xml | 6.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16540.png emd_16540.png | 47.6 KB | ||
| その他 |  emd_16540_half_map_1.map.gz emd_16540_half_map_1.map.gz emd_16540_half_map_2.map.gz emd_16540_half_map_2.map.gz | 12 MB 12 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16540 http://ftp.pdbj.org/pub/emdb/structures/EMD-16540 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16540 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16540 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16540_validation.pdf.gz emd_16540_validation.pdf.gz | 598.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16540_full_validation.pdf.gz emd_16540_full_validation.pdf.gz | 598 KB | 表示 | |
| XML形式データ |  emd_16540_validation.xml.gz emd_16540_validation.xml.gz | 11.2 KB | 表示 | |
| CIF形式データ |  emd_16540_validation.cif.gz emd_16540_validation.cif.gz | 14.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16540 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16540 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16540 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16540 | HTTPS FTP |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16540.map.gz / 形式: CCP4 / 大きさ: 12.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16540.map.gz / 形式: CCP4 / 大きさ: 12.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Volume map of the NF155 extracellular domain obtained by negative stain EM. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.31 Å | ||||||||||||||||||||||||||||||||||||
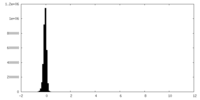
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: EM half map of the NF155 extracellular domain...
| ファイル | emd_16540_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | EM half map of the NF155 extracellular domain obtained by negative stain EM. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
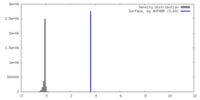
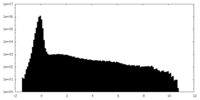
| 密度ヒストグラム |
-ハーフマップ: EM half map of the NF155 extracellular domain...
| ファイル | emd_16540_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | EM half map of the NF155 extracellular domain obtained by negative stain EM. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
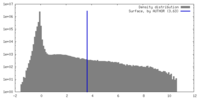
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Neurofascin isoform NF155
| 全体 | 名称: Neurofascin isoform NF155 |
|---|---|
| 要素 |
|
-超分子 #1: Neurofascin isoform NF155
| 超分子 | 名称: Neurofascin isoform NF155 / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Full length extracellular domain of neurofascin isoform NF155 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 140 KDa |
-分子 #1: Neurofascin isoform NF155
| 分子 | 名称: Neurofascin isoform NF155 / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: IEIPMDLTQP PTITKQSAKD HIVDPRDNIL IECEAKGNPA PSFHWTRNSR FFNIAKDPRV SMRRRSGTLV IDFRSGGRPE EYEGEYQCFA RNKFGTALSN RIRLQVSKSP LWPKENLDPV VVQEGAPLTL QCNPPPGLPS PVIFWMSSSM EPITQDKRVS QGHNGDLYFS ...文字列: IEIPMDLTQP PTITKQSAKD HIVDPRDNIL IECEAKGNPA PSFHWTRNSR FFNIAKDPRV SMRRRSGTLV IDFRSGGRPE EYEGEYQCFA RNKFGTALSN RIRLQVSKSP LWPKENLDPV VVQEGAPLTL QCNPPPGLPS PVIFWMSSSM EPITQDKRVS QGHNGDLYFS NVMLQDMQTD YSCNARFHFT HTIQQKNPFT LKVLTNHPYN DSSLRNHPDM YSARGVAERT PSFMYPQGTA SSQMVLRGMD LLLECIASGV PTPDIAWYKK GGDLPSDKAK FENFNKALRI TNVSEEDSGE YFCLASNKMG SIRHTISVRV KAAPYWLDEP KNLILAPGED GRLVCRANGN PKPTVQWMVN GEPLQSAPPN PNREVAGDTI IFRDTQISSR AVYQCNTSNE HGYLLANAFV SVLDVPPRML SPRNQLIRVI LYNRTRLDCP FFGSPIPTLR WFKNGQGSNL DGGNYHVYEN GSLEIKMIRK EDQGIYTCVA TNILGKAENQ VRLEVKDPTR IYRMPEDQVA RRGTTVQLEC RVKHDPSLKL TVSWLKDDEP LYIGNRMKKE DDSLTIFGVA ERDQGSYTCV ASTELDQDLA KAYLTVLGRP DRPRDLELTD LAERSVRLTW IPGDANNSPI TDYVVQFEED QFQPGVWHDH SKYPGSVNSA VLRLSPYVNY QFRVIAINEV GSSHPSLPSE RYRTSGAPPE SNPGDVKGEG TRKNNMEITW TPMNATSAFG PNLRYIVKWR RRETREAWNN VTVWGSRYVV GQTPVYVPYE IRVQAENDFG KGPEPESVIG YSGEDYPRAA PTEVKVRVMN STAISLQWNR VYSDTVQGQL REYRAYYWRE SSLLKNLWVS QKRQQASFPG DRLRGVVSRL FPYSNYKLEM VVVNGRGDGP RSETKEFTTP EGVPSAPRRF RVRQPNLETI NLEWDHPEHP NGIMIGYTLK YVAFNGTKVG KQIVENFSPN QTKFTVQRTD PVSRYRFTLS ARTQVGSGEA VTEESPAPPN EATPTAAYTN NQADIATQGK HHHHHH |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.0023 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 |
| 染色 | タイプ: NEGATIVE / 材質: Uranyl Acetate |
| 詳細 | This sample was highly pure and monodisperse |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TECNAI SPIRIT |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI EAGLE (4k x 4k) / 平均電子線量: 30.0 e/Å2 |
| 電子線 | 加速電圧: 120 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Tecnai Spirit / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)