+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM captures early ribosome assembly in action | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ribosome / ribosome assembly / ribosome biogenesis / total reconstitution / RNA / ribosomal protein. | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報transcriptional attenuation / endoribonuclease inhibitor activity / RNA-binding transcription regulator activity / negative regulation of cytoplasmic translation / translation repressor activity / assembly of large subunit precursor of preribosome / ribosome assembly / cytosolic ribosome assembly / DNA-templated transcription termination / mRNA 5'-UTR binding ...transcriptional attenuation / endoribonuclease inhibitor activity / RNA-binding transcription regulator activity / negative regulation of cytoplasmic translation / translation repressor activity / assembly of large subunit precursor of preribosome / ribosome assembly / cytosolic ribosome assembly / DNA-templated transcription termination / mRNA 5'-UTR binding / large ribosomal subunit / ribosomal large subunit assembly / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / cytoplasmic translation / negative regulation of translation / rRNA binding / structural constituent of ribosome / translation / response to antibiotic / negative regulation of DNA-templated transcription / DNA binding / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
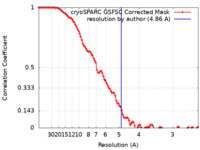
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.86 Å | |||||||||
 データ登録者 データ登録者 | Lauer S / Nikolay R / Qin B | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Cryo-EM captures early ribosome assembly in action. 著者: Bo Qin / Simon M Lauer / Annika Balke / Carlos H Vieira-Vieira / Jörg Bürger / Thorsten Mielke / Matthias Selbach / Patrick Scheerer / Christian M T Spahn / Rainer Nikolay /  要旨: Ribosome biogenesis is a fundamental multi-step cellular process in all domains of life that involves the production, processing, folding, and modification of ribosomal RNAs (rRNAs) and ribosomal ...Ribosome biogenesis is a fundamental multi-step cellular process in all domains of life that involves the production, processing, folding, and modification of ribosomal RNAs (rRNAs) and ribosomal proteins. To obtain insights into the still unexplored early assembly phase of the bacterial 50S subunit, we exploited a minimal in vitro reconstitution system using purified ribosomal components and scalable reaction conditions. Time-limited assembly assays combined with cryo-EM analysis visualizes the structurally complex assembly pathway starting with a particle consisting of ordered density for only ~500 nucleotides of 23S rRNA domain I and three ribosomal proteins. In addition, our structural analysis reveals that early 50S assembly occurs in a domain-wise fashion, while late 50S assembly proceeds incrementally. Furthermore, we find that both ribosomal proteins and folded rRNA helices, occupying surface exposed regions on pre-50S particles, induce, or stabilize rRNA folds within adjacent regions, thereby creating cooperativity. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16507.map.gz emd_16507.map.gz | 97.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16507-v30.xml emd-16507-v30.xml emd-16507.xml emd-16507.xml | 25.2 KB 25.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16507_fsc.xml emd_16507_fsc.xml | 9.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16507.png emd_16507.png | 40.6 KB | ||
| マスクデータ |  emd_16507_msk_1.map emd_16507_msk_1.map | 103 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-16507.cif.gz emd-16507.cif.gz | 7.5 KB | ||
| その他 |  emd_16507_half_map_1.map.gz emd_16507_half_map_1.map.gz emd_16507_half_map_2.map.gz emd_16507_half_map_2.map.gz | 95.5 MB 95.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16507 http://ftp.pdbj.org/pub/emdb/structures/EMD-16507 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16507 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16507 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16507_validation.pdf.gz emd_16507_validation.pdf.gz | 974.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16507_full_validation.pdf.gz emd_16507_full_validation.pdf.gz | 974.5 KB | 表示 | |
| XML形式データ |  emd_16507_validation.xml.gz emd_16507_validation.xml.gz | 17 KB | 表示 | |
| CIF形式データ |  emd_16507_validation.cif.gz emd_16507_validation.cif.gz | 22.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16507 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16507 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16507 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16507 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8c9aMC  8c8xC  8c8yC  8c8zC  8c90C  8c91C  8c92C  8c93C  8c94C  8c95C  8c96C  8c97C  8c98C  8c99C  8c9bC  8c9cC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16507.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16507.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.25 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_16507_msk_1.map emd_16507_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_16507_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_16507_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : large ribosomal subunit precursor d1_L4/L23
| 全体 | 名称: large ribosomal subunit precursor d1_L4/L23 |
|---|---|
| 要素 |
|
-超分子 #1: large ribosomal subunit precursor d1_L4/L23
| 超分子 | 名称: large ribosomal subunit precursor d1_L4/L23 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: 23S rRNA
| 分子 | 名称: 23S rRNA / タイプ: rna / ID: 1 詳細: Errorneous sequence alignment for 23S rRNA. Modelled residues: 15-527, 586-637, 1312-1347, 1382-1409 コピー数: 1 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 941.612375 KDa |
| 配列 | 文字列: GGUUAAGCGA CUAAGCGUAC ACGGUGGAUG CCCUGGCAGU CAGAGGCGAU GAAGGACGUG CUAAUCUGCG AUAAGCGUCG GUAAGGUGA UAUGAACCGU UAUAACCGGC GAUUUCCGAA UGGGGAAACC CAGUGUGUUU CGACACACUA UCAUUAACUG A AUCCAUAG ...文字列: GGUUAAGCGA CUAAGCGUAC ACGGUGGAUG CCCUGGCAGU CAGAGGCGAU GAAGGACGUG CUAAUCUGCG AUAAGCGUCG GUAAGGUGA UAUGAACCGU UAUAACCGGC GAUUUCCGAA UGGGGAAACC CAGUGUGUUU CGACACACUA UCAUUAACUG A AUCCAUAG GUUAAUGAGG CGAACCGGGG GAACUGAAAC AUCUAAGUAC CCCGAGGAAA AGAAAUCAAC CGAGAUUCCC CC AGUAGCG GCGAGCGAAC GGGGAGCAGC CCAGAGCCUG AAUCAGUGUG UGUGUUAGUG GAAGCGUCUG GAAAGGCGCG CGA UACAGG GUGACAGCCC CGUACACAAA AAUGCACAUG CUGUGAGCUC GAUGAGUAGG GCGGGACACG UGGUAUCCUG UCUG AAUAU GGGGGGACCA UCCUCCAAGG CUAAAUACUC CUGACUGACC GAUAGUGAAC CAGUACCGUG AGGGAAAGGC GAAAA GAAC CCCGGCGAGG GGAGUGAAAA AGAACCUGAA ACCGUGUACG UACAAGCAGU GGGAGCACGC UUAGGCGUGU GACUGC GUA CCUUUUGUAU AAUGGGUCAG CGACUUAUAU UCUGUAGCAA GGUUAACCGA AUAGGGGAGC CGAAGGGAAA CCGAGUC UU AACUGGGCGU UAAGUUGCAG GGUAUAGACC CGAAACCCGG UGAUCUAGCC AUGGGCAGGU UGAAGGUUGG GUAACACU A ACUGGAGGAC CGAACCGACU AAUGUUGAAA AAUUAGCGGA UGACUUGUGG CUGGGGGUGA AAGGCCAAUC AAACCGGGA GAUAGCUGGU UCUCCCCGAA AGCUAUUUAG GUAGCGCCUC GUGAAUUCAU CUCCGGGGGU AGAGCACUGU UUCGGCAAGG GGGUCAUCC CGACUUACCA ACCCGAUGCA AACUGCGAAU ACCGGAGAAU GUUAUCACGG GAGACACACG GCGGGUGCUA A CGUCCGUC GUGAAGAGGG AAACAACCCA GACCGCCAGC UAAGGUCCCA AAGUCAUGGU UAAGUGGGAA ACGAUGUGGG AA GGCCCAG ACAGCCAGGA UGUUGGCUUA GAAGCAGCCA UCAUUUAAAG AAAGCGUAAU AGCUCACUGG UCGAGUCGGC CUG CGCGGA AGAUGUAACG GGGCUAAACC AUGCACCGAA GCUGCGGCAG CGACGCUUAU GCGUUGUUGG GUAGGGGAGC GUUC UGUAA GCCUGCGAAG GUGUGCUGUG AGGCAUGCUG GAGGUAUCAG AAGUGCGAAU GCUGACAUAA GUAACGAUAA AGCGG GUGA AAAGCCCGCU CGCCGGAAGA CCAAGGGUUC CUGUCCAACG UUAAUCGGGG CAGGGUGAGU CGACCCCUAA GGCGAG GCC GAAAGGCGUA GUCGAUGGGA AACAGGUUAA UAUUCCUGUA CUUGGUGUUA CUGCGAAGGG GGGACGGAGA AGGCUAU GU UGGCCGGGCG ACGGUUGUCC CGGUUUAAGC GUGUAGGCUG GUUUUCCAGG CAAAUCCGGA AAAUCAAGGC UGAGGCGU G AUGACGAGGC ACUACGGUGC UGAAGCAACA AAUGCCCUGC UUCCAGGAAA AGCCUCUAAG CAUCAGGUAA CAUCAAAUC GUACCCCAAA CCGACACAGG UGGUCAGGUA GAGAAUACCA AGGCGCUUGA GAGAACUCGG GUGAAGGAAC UAGGCAAAAU GGUGCCGUA ACUUCGGGAG AAGGCACGCU GAUAUGUAGG UGAGGUCCCU CGCGGAUGGA GCUGAAAUCA GUCGAAGAUA C CAGCUGGC UGCAACUGUU UAUUAAAAAC ACAGCACUGU GCAAACACGA AAGUGGACGU AUACGGUGUG ACGCCUGCCC GG UGCCGGA AGGUUAAUUG AUGGGGUUAG CGCAAGCGAA GCUCUUGAUC GAAGCCCCGG UAAACGGCGG CCGUAACUAU AAC GGUCCU AAGGUAGCGA AAUUCCUUGU CGGGUAAGUU CCGACCUGCA CGAAUGGCGU AAUGAUGGCC AGGCUGUCUC CACC CGAGA CUCAGUGAAA UUGAACUCGC UGUGAAGAUG CAGUGUACCC GCGGCAAGAC GGAAAGACCC CGUGAACCUU UACUA UAGC UUGACACUGA ACAUUGAGCC UUGAUGUGUA GGAUAGGUGG GAGGCUUUGA AGUGUGGACG CCAGUCUGCA UGGAGC CGA CCUUGAAAUA CCACCCUUUA AUGUUUGAUG UUCUAACGUU GACCCGUAAU CCGGGUUGCG GACAGUGUCU GGUGGGU AG UUUGACUGGG GCGGUCUCCU CCUAAAGAGU AACGGAGGAG CACGAAGGUU GGCUAAUCCU GGUCGGACAU CAGGAGGU U AGUGCAAUGG CAUAAGCCAG CUUGACUGCG AGCGUGACGG CGCGAGCAGG UGCGAAAGCA GGUCAUAGUG AUCCGGUGG UUCUGAAUGG AAGGGCCAUC GCUCAACGGA UAAAAGGUAC UCCGGGGAUA ACAGGCUGAU ACCGCCCAAG AGUUCAUAUC GACGGCGGU GUUUGGCACC UCGAUGUCGG CUCAUCACAU CCUGGGGCUG AAGUAGGUCC CAAGGGUAUG GCUGUUCGCC A UUUAAAGU GGUACGCGAG CUGGGUUUAG AACGUCGUGA GACAGUUCGG UCCCUAUCUG CCGUGGGCGC UGGAGAACUG AG GGGGGCU GCUCCUAGUA CGAGAGGACC GGAGUGGACG CAUCACUGGU GUUCGGGUUG UCAUGCCAAU GGCACUGCCC GGU AGCUAA AUGCGGAAGA GAUAAGUGCU GAAAGCAUCU AAGCACGAAA CUUGCCCCGA GAUGAGUUCU CCCUGACCCU UUAA GGGUC CUGAAGGAAC GUUGAAGACG ACGACGUUGA UAGGCCGGGU GUGUAAGCGC AGCGAUGCGU UGAGCUAACC GGUAC UAAU GAACCGUGAG GCUUAACCUU GENBANK: GENBANK: CP011113.2 |
-分子 #2: 50S ribosomal protein L34
| 分子 | 名称: 50S ribosomal protein L34 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 5.397463 KDa |
| 配列 | 文字列: MKRTFQPSVL KRNRSHGFRA RMATKNGRQV LARRRAKGRA RLTVSK UniProtKB: Large ribosomal subunit protein bL34 |
-分子 #3: 50S ribosomal protein L4
| 分子 | 名称: 50S ribosomal protein L4 / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 22.121566 KDa |
| 配列 | 文字列: MELVLKDAQS ALTVSETTFG RDFNEALVHQ VVVAYAAGAR QGTRAQKTRA EVTGSGKKPW RQKGTGRARS GSIKSPIWRS GGVTFAARP QDHSQKVNKK MYRGALKSIL SELVRQDRLI VVEKFSVEAP KTKLLAQKLK DMALEDVLII TGELDENLFL A ARNLHKVD ...文字列: MELVLKDAQS ALTVSETTFG RDFNEALVHQ VVVAYAAGAR QGTRAQKTRA EVTGSGKKPW RQKGTGRARS GSIKSPIWRS GGVTFAARP QDHSQKVNKK MYRGALKSIL SELVRQDRLI VVEKFSVEAP KTKLLAQKLK DMALEDVLII TGELDENLFL A ARNLHKVD VRDATGIDPV SLIAFDKVVM TADAVKQVEE MLA UniProtKB: Large ribosomal subunit protein uL4 |
-分子 #4: 50S ribosomal protein L22
| 分子 | 名称: 50S ribosomal protein L22 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 12.253359 KDa |
| 配列 | 文字列: METIAKHRHA RSSAQKVRLV ADLIRGKKVS QALDILTYTN KKAAVLVKKV LESAIANAEH NDGADIDDLK VTKIFVDEGP SMKRIMPRA KGRADRILKR TSHITVVVSD R UniProtKB: Large ribosomal subunit protein uL22 |
-分子 #5: 50S ribosomal protein L24
| 分子 | 名称: 50S ribosomal protein L24 / タイプ: protein_or_peptide / ID: 5 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 11.33925 KDa |
| 配列 | 文字列: MAAKIRRDDE VIVLTGKDKG KRGKVKNVLS SGKVIVEGIN LVKKHQKPVP ALNQPGGIVE KEAAIQVSNV AIFNAATGKA DRVGFRFED GKKVRFFKSN SETIK UniProtKB: Large ribosomal subunit protein uL24 |
-分子 #6: 50S ribosomal protein L29
| 分子 | 名称: 50S ribosomal protein L29 / タイプ: protein_or_peptide / ID: 6 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 7.286464 KDa |
| 配列 | 文字列: MKAKELREKS VEELNTELLN LLREQFNLRM QAASGQLQQS HLLKQVRRDV ARVKTLLNEK AGA UniProtKB: Large ribosomal subunit protein uL29 |
-分子 #7: 50S ribosomal protein L23
| 分子 | 名称: 50S ribosomal protein L23 / タイプ: protein_or_peptide / ID: 7 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 11.22216 KDa |
| 配列 | 文字列: MIREERLLKV LRAPHVSEKA STAMEKSNTI VLKVAKDATK AEIKAAVQKL FEVEVEVVNT LVVKGKVKRH GQRIGRRSDW KKAYVTLKE GQNLDFVGGA E UniProtKB: Large ribosomal subunit protein uL23 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.6 |
|---|---|
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 温度 | 最低: 82.0 K / 最高: 83.0 K |
| ソフトウェア | 名称: Leginon |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均露光時間: 10.0 sec. / 平均電子線量: 62.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER / Cs: 2.0 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 31000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| ソフトウェア | 名称:  Coot (ver. 0.9.6.2) Coot (ver. 0.9.6.2) |
|---|---|
| 精密化 | 空間: REAL |
| 得られたモデル |  PDB-8c9a: |
 ムービー
ムービー コントローラー
コントローラー






















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)