+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Outer membrane attachment porin OmpM1 from Veillonella parvula | |||||||||
 マップデータ マップデータ | B-factor (-70.2 angstrom sq.) sharpened map from non-uniform refinement | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Porin / outer membrane / attachment / peptidoglycan-binding / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 | : / S-layer homology domain / S-layer homology domain / S-layer homology (SLH) domain profile. / S-layer homology domain-containing protein 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Veillonella parvula (バクテリア) Veillonella parvula (バクテリア) | |||||||||
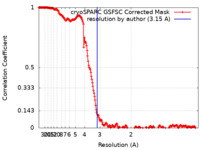
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.15 Å | |||||||||
 データ登録者 データ登録者 | Silale A / van den Berg B | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Dual function of OmpM as outer membrane tether and nutrient uptake channel in diderm Firmicutes. 著者: Augustinas Silale / Yiling Zhu / Jerzy Witwinowski / Robert E Smith / Kahlan E Newman / Satya P Bhamidimarri / Arnaud Baslé / Syma Khalid / Christophe Beloin / Simonetta Gribaldo / Bert van den Berg /   要旨: The outer membrane (OM) in diderm, or Gram-negative, bacteria must be tethered to peptidoglycan for mechanical stability and to maintain cell morphology. Most diderm phyla from the Terrabacteria ...The outer membrane (OM) in diderm, or Gram-negative, bacteria must be tethered to peptidoglycan for mechanical stability and to maintain cell morphology. Most diderm phyla from the Terrabacteria group have recently been shown to lack well-characterised OM attachment systems, but instead have OmpM, which could represent an ancestral tethering system in bacteria. Here, we have determined the structure of the most abundant OmpM protein from Veillonella parvula (diderm Firmicutes) by single particle cryogenic electron microscopy. We also characterised the channel properties of the transmembrane β-barrel of OmpM and investigated the structure and PG-binding properties of its periplasmic stalk region. Our results show that OM tethering and nutrient acquisition are genetically linked in V. parvula, and probably other diderm Terrabacteria. This dual function of OmpM may have played a role in the loss of the OM in ancestral bacteria and the emergence of monoderm bacterial lineages. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16328.map.gz emd_16328.map.gz | 778.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16328-v30.xml emd-16328-v30.xml emd-16328.xml emd-16328.xml | 16.6 KB 16.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16328_fsc.xml emd_16328_fsc.xml | 19.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16328.png emd_16328.png | 40.8 KB | ||
| マスクデータ |  emd_16328_msk_1.map emd_16328_msk_1.map | 824 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-16328.cif.gz emd-16328.cif.gz | 5.9 KB | ||
| その他 |  emd_16328_half_map_1.map.gz emd_16328_half_map_1.map.gz emd_16328_half_map_2.map.gz emd_16328_half_map_2.map.gz | 765.5 MB 765.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16328 http://ftp.pdbj.org/pub/emdb/structures/EMD-16328 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16328 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16328 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16328_validation.pdf.gz emd_16328_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16328_full_validation.pdf.gz emd_16328_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_16328_validation.xml.gz emd_16328_validation.xml.gz | 29.6 KB | 表示 | |
| CIF形式データ |  emd_16328_validation.cif.gz emd_16328_validation.cif.gz | 38.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16328 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16328 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16328 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16328 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16328.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16328.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | B-factor (-70.2 angstrom sq.) sharpened map from non-uniform refinement | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.574 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_16328_msk_1.map emd_16328_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map B
| ファイル | emd_16328_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map A
| ファイル | emd_16328_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Veillonella parvula OmpM1 outer membrane attachment porin trimer
| 全体 | 名称: Veillonella parvula OmpM1 outer membrane attachment porin trimer |
|---|---|
| 要素 |
|
-超分子 #1: Veillonella parvula OmpM1 outer membrane attachment porin trimer
| 超分子 | 名称: Veillonella parvula OmpM1 outer membrane attachment porin trimer タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Veillonella parvula (バクテリア) / 株: SKV38 Veillonella parvula (バクテリア) / 株: SKV38 |
| 分子量 | 理論値: 130 KDa |
-分子 #1: S-layer homology domain-containing protein
| 分子 | 名称: S-layer homology domain-containing protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Veillonella parvula (バクテリア) / 株: SKV38 Veillonella parvula (バクテリア) / 株: SKV38 |
| 分子量 | 理論値: 47.555062 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MRYIRQLCCV SLLCLSGSAA AANVRLQHHH HHHHLEAANP FSDVTPDSWA YQAVSQLAQA GIVNGYPDGT FKGQNNITRY EMAQMVAKA MANQDRANAE QQAMINRLAD EFSNELNNLG VRVSRLEDRV GNVKVTGDAR IRYQGSEDKG VYKANSKSLT D GRARVQFN ...文字列: MRYIRQLCCV SLLCLSGSAA AANVRLQHHH HHHHLEAANP FSDVTPDSWA YQAVSQLAQA GIVNGYPDGT FKGQNNITRY EMAQMVAKA MANQDRANAE QQAMINRLAD EFSNELNNLG VRVSRLEDRV GNVKVTGDAR IRYQGSEDKG VYKANSKSLT D GRARVQFN ANVNDKTQAV VRVKGNYEFG DSTKGSQATI DRAYVDHKFG SNVSAKAGRF QQTIGGGLMY DDTFDGAQLN VG NDKVQVQ GAYGYMIDGA ADGNSKSDNP SVSYVGLKGK VGKESSVGGF YSRLSSGNLN HNGVTVNSDK QDVYGFNADF RKN KLWAGG EWLKASNVDN SQAWTAGLGY GNYDIAKKGT WDVKGQYFNQ KANAPIVSST WDQAYDLTNT SNGYKGYMAS VDYA VQDNV GLSAGYGFNS KDQSGNDLSD FYRAELNYKF UniProtKB: S-layer homology domain-containing protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 11.6 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 詳細: 10 mM HEPES-NaOH pH 7.5, 100 mM NaCl, 0.12% decyl maltoside (DM) |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 4284 / 平均電子線量: 50.1 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 240000 |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-8bym: |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)