[日本語] English
 万見
万見- EMDB-15525: Cryo-EM structure of the RecA postsynaptic filament from S. pneumoniae -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the RecA postsynaptic filament from S. pneumoniae | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Helical reconstruction / Recombinase / Streptococcus pneumoniae / double-stranded DNA / RECOMBINATION | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報establishment of competence for transformation / SOS response / ATP-dependent DNA damage sensor activity / single-stranded DNA binding / DNA recombination / damaged DNA binding / DNA repair / ATP hydrolysis activity / ATP binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   Lambdavirus lambda (ウイルス) Lambdavirus lambda (ウイルス) | |||||||||
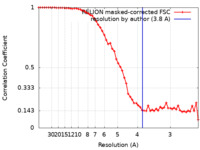
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||
 データ登録者 データ登録者 | Perry TN / Fronzes R / Polard P / Hertzog M | |||||||||
| 資金援助 | European Union, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2023 ジャーナル: Nucleic Acids Res / 年: 2023タイトル: Assembly mechanism and cryoEM structure of RecA recombination nucleofilaments from Streptococcus pneumoniae. 著者: Maud Hertzog / Thomas Noé Perry / Pauline Dupaigne / Sandra Serres / Violette Morales / Anne-Lise Soulet / Jason C Bell / Emmanuel Margeat / Stephen C Kowalczykowski / Eric Le Cam / Rémi ...著者: Maud Hertzog / Thomas Noé Perry / Pauline Dupaigne / Sandra Serres / Violette Morales / Anne-Lise Soulet / Jason C Bell / Emmanuel Margeat / Stephen C Kowalczykowski / Eric Le Cam / Rémi Fronzes / Patrice Polard /   要旨: RecA-mediated homologous recombination (HR) is a key mechanism for genome maintenance and plasticity in bacteria. It proceeds through RecA assembly into a dynamic filament on ssDNA, the presynaptic ...RecA-mediated homologous recombination (HR) is a key mechanism for genome maintenance and plasticity in bacteria. It proceeds through RecA assembly into a dynamic filament on ssDNA, the presynaptic filament, which mediates DNA homology search and ordered DNA strand exchange. Here, we combined structural, single molecule and biochemical approaches to characterize the ATP-dependent assembly mechanism of the presynaptic filament of RecA from Streptococcus pneumoniae (SpRecA), in comparison to the Escherichia coli RecA (EcRecA) paradigm. EcRecA polymerization on ssDNA is assisted by the Single-Stranded DNA Binding (SSB) protein, which unwinds ssDNA secondary structures that block EcRecA nucleofilament growth. We report by direct microscopic analysis of SpRecA filamentation on ssDNA that neither of the two paralogous pneumococcal SSBs could assist the extension of SpRecA nucleopolymers. Instead, we found that the conserved RadA helicase promotes SpRecA nucleofilamentation in an ATP-dependent manner. This allowed us to solve the atomic structure of such a long native SpRecA nucleopolymer by cryoEM stabilized with ATPγS. It was found to be equivalent to the crystal structure of the EcRecA filament with a marked difference in how RecA mediates nucleotide orientation in the stretched ssDNA. Then, our results show that SpRecA and EcRecA HR activities are different, in correlation with their distinct ATP-dependent ssDNA binding modes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15525.map.gz emd_15525.map.gz | 14.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15525-v30.xml emd-15525-v30.xml emd-15525.xml emd-15525.xml | 19.9 KB 19.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15525_fsc.xml emd_15525_fsc.xml | 5.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15525.png emd_15525.png | 93.5 KB | ||
| Filedesc metadata |  emd-15525.cif.gz emd-15525.cif.gz | 6.6 KB | ||
| その他 |  emd_15525_half_map_1.map.gz emd_15525_half_map_1.map.gz emd_15525_half_map_2.map.gz emd_15525_half_map_2.map.gz | 4.6 MB 4.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15525 http://ftp.pdbj.org/pub/emdb/structures/EMD-15525 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15525 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15525 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15525_validation.pdf.gz emd_15525_validation.pdf.gz | 761.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15525_full_validation.pdf.gz emd_15525_full_validation.pdf.gz | 761.3 KB | 表示 | |
| XML形式データ |  emd_15525_validation.xml.gz emd_15525_validation.xml.gz | 11.5 KB | 表示 | |
| CIF形式データ |  emd_15525_validation.cif.gz emd_15525_validation.cif.gz | 15.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15525 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15525 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15525 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15525 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8amfMC  8amdC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15525.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15525.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.24 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_15525_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
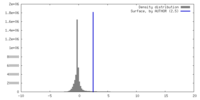
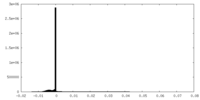
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_15525_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RecA postsynaptic complex from S. pneumoniae
| 全体 | 名称: RecA postsynaptic complex from S. pneumoniae |
|---|---|
| 要素 |
|
-超分子 #1: RecA postsynaptic complex from S. pneumoniae
| 超分子 | 名称: RecA postsynaptic complex from S. pneumoniae / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Protein RecA
| 分子 | 名称: Protein RecA / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 42.007703 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAKKPKKLEE ISKKFGAERE KALNDALKLI EKDFGKGSIM RLGERAEQKV QVMSSGSLAL DIALGSGGYP KGRIIEIYGP ESSGKTTVA LHAVAQAQKE GGIAAFIDAE HALDPAYAAA LGVNIDELLL SQPDSGEQGL EIAGKLIDSG AVDLVVVDSV A ALVPRAEI ...文字列: MAKKPKKLEE ISKKFGAERE KALNDALKLI EKDFGKGSIM RLGERAEQKV QVMSSGSLAL DIALGSGGYP KGRIIEIYGP ESSGKTTVA LHAVAQAQKE GGIAAFIDAE HALDPAYAAA LGVNIDELLL SQPDSGEQGL EIAGKLIDSG AVDLVVVDSV A ALVPRAEI DGDIGDSHVG LQARMMSQAM RKLGASINKT KTIAIFINQL REKVGVMFGN PETTPGGRAL KFYASVRLDV RG NTQIKGT GDQKETNVGK ETKIKVVKNK VAPPFKEAVV EIMYGEGISK TGELLKIASD LDIIKKAGAW YSYKDEKIGQ GSE NAKKYL AEHPEIFDEI DKQVRSKFGL IDGEEVSEQD TENKKDEPKK EEAVNEEVPL DLGDELEIEI EE UniProtKB: Protein RecA |
-分子 #2: DNA
| 分子 | 名称: DNA / タイプ: dna / ID: 2 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  Lambdavirus lambda (ウイルス) Lambdavirus lambda (ウイルス) |
| 分子量 | 理論値: 3.08711 KDa |
| 配列 | 文字列: (DA)(DA)(DA)(DA)(DA)(DA)(DA)(DA)(DA)(DA) |
-分子 #3: DNA
| 分子 | 名称: DNA / タイプ: dna / ID: 3 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  Lambdavirus lambda (ウイルス) Lambdavirus lambda (ウイルス) |
| 分子量 | 理論値: 2.996971 KDa |
| 配列 | 文字列: (DT)(DT)(DT)(DT)(DT)(DT)(DT)(DT)(DT)(DT) |
-分子 #4: PHOSPHOTHIOPHOSPHORIC ACID-ADENYLATE ESTER
| 分子 | 名称: PHOSPHOTHIOPHOSPHORIC ACID-ADENYLATE ESTER / タイプ: ligand / ID: 4 / コピー数: 4 / 式: AGS |
|---|---|
| 分子量 | 理論値: 523.247 Da |
| Chemical component information |  ChemComp-AGS: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.2 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: EMS Lacey Carbon / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 2364 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)