+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
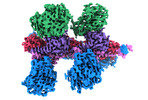
| タイトル | Cryo-EM structure of Hydrogen-dependent CO2 reductase. | ||||||||||||||||||
 マップデータ マップデータ | 3.4 Angstrom Cryo-EM structure of HDCR complex. The data was processed using cryosparc software. | ||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||
 キーワード キーワード | Hydrogen-dependent CO2 reduction / Carbon fixation / Protein nanowire filament / enzyme catalysis / ELECTRON TRANSPORT | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報formate metabolic process / formate dehydrogenase / ferredoxin hydrogenase / formate dehydrogenase (NAD+) activity / 酸化還元酵素 / ferredoxin hydrogenase activity / molybdopterin cofactor binding / iron-sulfur cluster binding / 4 iron, 4 sulfur cluster binding / oxidoreductase activity ...formate metabolic process / formate dehydrogenase / ferredoxin hydrogenase / formate dehydrogenase (NAD+) activity / 酸化還元酵素 / ferredoxin hydrogenase activity / molybdopterin cofactor binding / iron-sulfur cluster binding / 4 iron, 4 sulfur cluster binding / oxidoreductase activity / iron ion binding / metal ion binding 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |   Thermoanaerobacter kivui LKT-1 (バクテリア) / Thermoanaerobacter kivui LKT-1 (バクテリア) /   Thermoanaerobacter kivui (バクテリア) Thermoanaerobacter kivui (バクテリア) | ||||||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Dietrich HM / Righetto RD / Kumar A / Wietrzynski W / Schuller SK / Trischler R / Wagner J / Schwarz FM / Engel BD / Mueller V / Schuller JM | ||||||||||||||||||
| 資金援助 |  ドイツ, European Union, 5件 ドイツ, European Union, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2022 ジャーナル: Nature / 年: 2022タイトル: Membrane-anchored HDCR nanowires drive hydrogen-powered CO fixation. 著者: Helge M Dietrich / Ricardo D Righetto / Anuj Kumar / Wojciech Wietrzynski / Raphael Trischler / Sandra K Schuller / Jonathan Wagner / Fabian M Schwarz / Benjamin D Engel / Volker Müller / Jan M Schuller /   要旨: Filamentous enzymes have been found in all domains of life, but the advantage of filamentation is often elusive. Some anaerobic, autotrophic bacteria have an unusual filamentous enzyme for CO ...Filamentous enzymes have been found in all domains of life, but the advantage of filamentation is often elusive. Some anaerobic, autotrophic bacteria have an unusual filamentous enzyme for CO fixation-hydrogen-dependent CO reductase (HDCR)-which directly converts H and CO into formic acid. HDCR reduces CO with a higher activity than any other known biological or chemical catalyst, and it has therefore gained considerable interest in two areas of global relevance: hydrogen storage and combating climate change by capturing atmospheric CO. However, the mechanistic basis of the high catalytic turnover rate of HDCR has remained unknown. Here we use cryo-electron microscopy to reveal the structure of a short HDCR filament from the acetogenic bacterium Thermoanaerobacter kivui. The minimum repeating unit is a hexamer that consists of a formate dehydrogenase (FdhF) and two hydrogenases (HydA2) bound around a central core of hydrogenase Fe-S subunits, one HycB3 and two HycB4. These small bacterial polyferredoxin-like proteins oligomerize through their C-terminal helices to form the backbone of the filament. By combining structure-directed mutagenesis with enzymatic analysis, we show that filamentation and rapid electron transfer through the filament enhance the activity of HDCR. To investigate the structure of HDCR in situ, we imaged T. kivui cells with cryo-electron tomography and found that HDCR filaments bundle into large ring-shaped superstructures attached to the plasma membrane. This supramolecular organization may further enhance the stability and connectivity of HDCR to form a specialized metabolic subcompartment within the cell. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14169.map.gz emd_14169.map.gz | 157.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14169-v30.xml emd-14169-v30.xml emd-14169.xml emd-14169.xml | 19.3 KB 19.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_14169.png emd_14169.png | 108.3 KB | ||
| Filedesc metadata |  emd-14169.cif.gz emd-14169.cif.gz | 7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14169 http://ftp.pdbj.org/pub/emdb/structures/EMD-14169 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14169 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14169 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14169_validation.pdf.gz emd_14169_validation.pdf.gz | 463.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14169_full_validation.pdf.gz emd_14169_full_validation.pdf.gz | 463.2 KB | 表示 | |
| XML形式データ |  emd_14169_validation.xml.gz emd_14169_validation.xml.gz | 6.8 KB | 表示 | |
| CIF形式データ |  emd_14169_validation.cif.gz emd_14169_validation.cif.gz | 7.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14169 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14169 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14169 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14169 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7qv7MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14169.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14169.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3.4 Angstrom Cryo-EM structure of HDCR complex. The data was processed using cryosparc software. | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.09 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Hydrogen-dependent CO2 reductase (HDCR) complex with iron-sulphur...
| 全体 | 名称: Hydrogen-dependent CO2 reductase (HDCR) complex with iron-sulphur clusters and the H-cluster. |
|---|---|
| 要素 |
|
-超分子 #1: Hydrogen-dependent CO2 reductase (HDCR) complex with iron-sulphur...
| 超分子 | 名称: Hydrogen-dependent CO2 reductase (HDCR) complex with iron-sulphur clusters and the H-cluster. タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 詳細: A single functional unit of HDCR complex consists of 4 subunits - FdhF, HydA2, HycB3, and HycB4(1) |
|---|---|
| 由来(天然) | 生物種:   Thermoanaerobacter kivui LKT-1 (バクテリア) Thermoanaerobacter kivui LKT-1 (バクテリア) |
-分子 #1: Hydrogen dependent carbon dioxide reductase subunit HycB3
| 分子 | 名称: Hydrogen dependent carbon dioxide reductase subunit HycB3 タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: 酸化還元酵素 |
|---|---|
| 由来(天然) | 生物種:   Thermoanaerobacter kivui (バクテリア) Thermoanaerobacter kivui (バクテリア) |
| 分子量 | 理論値: 20.520934 KDa |
| 配列 | 文字列: MPNRFVIADP KRCLGCYTCI AACAFVHEEQ GLQPFPRLYL TYTSEGIMPI QCRHCEDAPC AEVCPVEAIK KEGNAIIIDE KACIGCKTC LLACSFGAID FSVQDSLEQS IFKDIKENLM QDQKTQQRIV AVKCDLCNFR EEGPACVQFC PTKALKLVDG D EINKMVKN KRTVNVESLL SVYGTK UniProtKB: Hydrogen dependent carbon dioxide reductase subunit HycB3 |
-分子 #2: Hydrogen dependent carbon dioxide reductase subunit HycB4
| 分子 | 名称: Hydrogen dependent carbon dioxide reductase subunit HycB4 タイプ: protein_or_peptide / ID: 2 / コピー数: 6 / 光学異性体: LEVO / EC番号: 酸化還元酵素 |
|---|---|
| 由来(天然) | 生物種:   Thermoanaerobacter kivui (バクテリア) Thermoanaerobacter kivui (バクテリア) |
| 分子量 | 理論値: 23.05218 KDa |
| 配列 | 文字列: MYQKVNCYSI LFLKGVDKMK TQLNPFVVAN PAKCIGCKAC EVACFAVHNR NNHVGATVGT VSIPVIPRLH LIKTEHGTMP IQCRHCEDA PCANVCTVGA IKREGNAIVV DEKLCIGCKS CLLACPFGAI ELLPQYEDGR EVFQINLKEE SESGLVQEPR I IAYKCDLC ...文字列: MYQKVNCYSI LFLKGVDKMK TQLNPFVVAN PAKCIGCKAC EVACFAVHNR NNHVGATVGT VSIPVIPRLH LIKTEHGTMP IQCRHCEDA PCANVCTVGA IKREGNAIVV DEKLCIGCKS CLLACPFGAI ELLPQYEDGR EVFQINLKEE SESGLVQEPR I IAYKCDLC NDLGEPACVK ACPENALTLV MPTEMKKARN KEAALSFLRV VR UniProtKB: Hydrogen dependent carbon dioxide reductase subunit HycB4 |
-分子 #3: Hydrogen dependent carbon dioxide reductase subunit HydA2
| 分子 | 名称: Hydrogen dependent carbon dioxide reductase subunit HydA2 タイプ: protein_or_peptide / ID: 3 / コピー数: 6 / 光学異性体: LEVO / EC番号: ferredoxin hydrogenase |
|---|---|
| 由来(天然) | 生物種:   Thermoanaerobacter kivui (バクテリア) Thermoanaerobacter kivui (バクテリア) |
| 分子量 | 理論値: 51.43027 KDa |
| 配列 | 文字列: MSANKAIINI DQELCTGCRR CAEVCPVDAI EGEKGKPQKI NTEVCVMCGQ CVQKCSSYAS YFDESITPRN VKLQERGMLD SVKEPLFAA YNLGYARQVK EALENPQLFK VVQCAPAIRV SIAEEFGLDL GDLTPGKLVA ALRRLNFDRV YDTNFGADLT I IEEANELV ...文字列: MSANKAIINI DQELCTGCRR CAEVCPVDAI EGEKGKPQKI NTEVCVMCGQ CVQKCSSYAS YFDESITPRN VKLQERGMLD SVKEPLFAA YNLGYARQVK EALENPQLFK VVQCAPAIRV SIAEEFGLDL GDLTPGKLVA ALRRLNFDRV YDTNFGADLT I IEEANELV KRIKEGKDLP MFTSCCPAWV KFAEQTYPEL LKHISTCKSP QQMTGAIIKT YGAKINNVDP AKIFSVSVMP CT CKSYESD RPEMRSSGYK DVDLVITTRE LAHLMKDKGI DFATLPDEEF DSPLGNYTGA ATIFGNTGGV MEAALRTAYE LIT KKPIPN IDIEFVRGGE GIRTATVQVG ELELKIAVVS GLKNVIPILE DIKKNKCDLH FVEVMTCPEG CISGGGQPKL LLEE YREVA YKKRKEALYK HDAELELRKS HENPAIKKLY EEFLGEPLGK QSHHLLHTKY TPRKKV UniProtKB: Hydrogen dependent carbon dioxide reductase subunit HydA2 |
-分子 #4: Hydrogen dependent carbon dioxide reductase subunit FdhF
| 分子 | 名称: Hydrogen dependent carbon dioxide reductase subunit FdhF タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO / EC番号: formate dehydrogenase |
|---|---|
| 由来(天然) | 生物種:   Thermoanaerobacter kivui (バクテリア) Thermoanaerobacter kivui (バクテリア) |
| 分子量 | 理論値: 82.505711 KDa |
| 配列 | 文字列: MKDGKQEKVL TTCPYCGTGC GLYLKVENEK IVGVEPDKLH PVNQGELCIK GYYGYKYVHD PRRLTSPLIK KNGKFVPVSW DEALNFIAN GLKKIKSEYG SDAFAMFCSA RATNEDNYAA QKFARAVIGI NNVDHCARLC HAPTVAGLAM TLGSGAMTNS I PEISTYSD ...文字列: MKDGKQEKVL TTCPYCGTGC GLYLKVENEK IVGVEPDKLH PVNQGELCIK GYYGYKYVHD PRRLTSPLIK KNGKFVPVSW DEALNFIAN GLKKIKSEYG SDAFAMFCSA RATNEDNYAA QKFARAVIGI NNVDHCARLC HAPTVAGLAM TLGSGAMTNS I PEISTYSD VIFIIGSNTA ECHPLIAAHV IKAKERGAKL IVADPRMNAM VHKADIWLRV PSGYNIPLIN GMIHIIIKEG LV KTDFVKN HAVGFEEMAK AVEKYTPEYV EELTGIPKKD LIKAARFYGQ AQAAAILYSM GVTQFSHGTG NVVSLANLAV ITG NLGRPG AGICPLRGQN NVQGACDVGA LPNVLPGYLD VTKEQNRERF EKVWGVKLPS NIGLRVTEVP DAILNKRVRA LYIF GENPI MSDPDSDHLR HALEHLDLLI VQDIFLTETA RLAHVVLPAA CWAEKDGTFT NTERRVQRVR KAVEAPGEAK PDWWI FSQI AERMGYTGMQ YNNVQEIWDE VRKIVPEKFG GISYARLEKE KGLAWPCPTE DHTGTPILYL GGKFATPSGK AQMYPV IFY PNTCICDEGA EKQDFNHVIV GSIAELPDEE YPFTLTTGRR VYHYHTATMT RKSPVIDQIA PQELVEINPQ DATRLGI ND GDFLRVSTRR GYVATRAWVT ERVPKGTIFM TFHYWEACCN ELTNTASDAI CCIPEFKVAA AKVEKISQVE AQAILKEK I EKYQVELEKD VANMLAKEKG GK UniProtKB: Hydrogen dependent carbon dioxide reductase subunit FdhF |
-分子 #5: IRON/SULFUR CLUSTER
| 分子 | 名称: IRON/SULFUR CLUSTER / タイプ: ligand / ID: 5 / コピー数: 52 / 式: SF4 |
|---|---|
| 分子量 | 理論値: 351.64 Da |
| Chemical component information |  ChemComp-FS1: |
-分子 #6: dicarbonyl[bis(cyanide-kappaC)]-mu-(iminodimethanethiolatato-1kap...
| 分子 | 名称: dicarbonyl[bis(cyanide-kappaC)]-mu-(iminodimethanethiolatato-1kappaS:2kappaS)-mu-(oxomethylidene)diiron(2+) タイプ: ligand / ID: 6 / コピー数: 6 / 式: 402 |
|---|---|
| 分子量 | 理論値: 354.953 Da |
| Chemical component information |  ChemComp-402: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 5.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)




















