+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of full-length, dimeric, soluble somatic angiotensin I-converting enzyme | |||||||||
 マップデータ マップデータ | Globally-sharpened map of full-length dimeric somatic angiotensin I-converting enzyme showing interacting N-domains and disordered C-domains | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Zinc metalloprotease Dicarboxypeptidase Glycoprotein / HYDROLASE | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
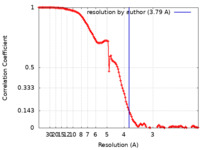
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.79 Å | |||||||||
 データ登録者 データ登録者 | Lubbe L / Sewell BT / Sturrock ED | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: EMBO J / 年: 2022 ジャーナル: EMBO J / 年: 2022タイトル: Cryo-EM reveals mechanisms of angiotensin I-converting enzyme allostery and dimerization. 著者: Lizelle Lubbe / Bryan Trevor Sewell / Jeremy D Woodward / Edward D Sturrock /  要旨: Hypertension (high blood pressure) is a major risk factor for cardiovascular disease, which is the leading cause of death worldwide. The somatic isoform of angiotensin I-converting enzyme (sACE) ...Hypertension (high blood pressure) is a major risk factor for cardiovascular disease, which is the leading cause of death worldwide. The somatic isoform of angiotensin I-converting enzyme (sACE) plays a critical role in blood pressure regulation, and ACE inhibitors are thus widely used to treat hypertension and cardiovascular disease. Our current understanding of sACE structure, dynamics, function, and inhibition has been limited because truncated, minimally glycosylated forms of sACE are typically used for X-ray crystallography and molecular dynamics simulations. Here, we report the first cryo-EM structures of full-length, glycosylated, soluble sACE (sACE ). Both monomeric and dimeric forms of the highly flexible apo enzyme were reconstructed from a single dataset. The N- and C-terminal domains of monomeric sACE were resolved at 3.7 and 4.1 Å, respectively, while the interacting N-terminal domains responsible for dimer formation were resolved at 3.8 Å. Mechanisms are proposed for intradomain hinging, cooperativity, and homodimerization. Furthermore, the observation that both domains were in the open conformation has implications for the design of sACE modulators. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13802.map.gz emd_13802.map.gz | 168.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13802-v30.xml emd-13802-v30.xml emd-13802.xml emd-13802.xml | 23.5 KB 23.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13802_fsc.xml emd_13802_fsc.xml | 12.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13802.png emd_13802.png | 63.8 KB | ||
| マスクデータ |  emd_13802_msk_1.map emd_13802_msk_1.map emd_13802_msk_2.map emd_13802_msk_2.map | 178 MB 178 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-13802.cif.gz emd-13802.cif.gz | 6.7 KB | ||
| その他 |  emd_13802_additional_1.map.gz emd_13802_additional_1.map.gz emd_13802_half_map_1.map.gz emd_13802_half_map_1.map.gz emd_13802_half_map_2.map.gz emd_13802_half_map_2.map.gz | 164.8 MB 165.4 MB 165.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13802 http://ftp.pdbj.org/pub/emdb/structures/EMD-13802 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13802 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13802 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_13802_validation.pdf.gz emd_13802_validation.pdf.gz | 852.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_13802_full_validation.pdf.gz emd_13802_full_validation.pdf.gz | 852.1 KB | 表示 | |
| XML形式データ |  emd_13802_validation.xml.gz emd_13802_validation.xml.gz | 20.7 KB | 表示 | |
| CIF形式データ |  emd_13802_validation.cif.gz emd_13802_validation.cif.gz | 26.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13802 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13802 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13802 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13802 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7q3yC  7q49C  7q4cC  7q4dC  7q4eC C: 同じ文献を引用 ( |
|---|---|
| 電子顕微鏡画像生データ |  EMPIAR-10980 (タイトル: Cryo-EM structures of monomeric and dimeric human somatic angiotensin I-converting enzyme (apo form) EMPIAR-10980 (タイトル: Cryo-EM structures of monomeric and dimeric human somatic angiotensin I-converting enzyme (apo form)Data size: 3.8 TB Data #1: Unaligned multi-frame cryo-EM micrographs of human somatic angiotensin I-converting enzyme in the apo state [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13802.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13802.map.gz / 形式: CCP4 / 大きさ: 178 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Globally-sharpened map of full-length dimeric somatic angiotensin I-converting enzyme showing interacting N-domains and disordered C-domains | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.06 Å | ||||||||||||||||||||||||||||||||||||
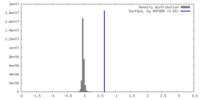
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_13802_msk_1.map emd_13802_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-マスク #2
| ファイル |  emd_13802_msk_2.map emd_13802_msk_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Raw, unfiltered full map from non-uniform refinement of...
| ファイル | emd_13802_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Raw, unfiltered full map from non-uniform refinement of full-length dimeric somatic angiotensin I-converting enzyme | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Raw, unfiltered half-map A of full-length dimeric somatic...
| ファイル | emd_13802_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Raw, unfiltered half-map A of full-length dimeric somatic angiotensin I-converting enzyme | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Raw, unfiltered half-map B of full-length dimeric somatic...
| ファイル | emd_13802_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Raw, unfiltered half-map B of full-length dimeric somatic angiotensin I-converting enzyme | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Full-length, soluble, dimeric somatic angiotensin I-converting enzyme
| 全体 | 名称: Full-length, soluble, dimeric somatic angiotensin I-converting enzyme |
|---|---|
| 要素 |
|
-超分子 #1: Full-length, soluble, dimeric somatic angiotensin I-converting enzyme
| 超分子 | 名称: Full-length, soluble, dimeric somatic angiotensin I-converting enzyme タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 279 KDa |
-分子 #1: Angiotensin I-converting enzyme
| 分子 | 名称: Angiotensin I-converting enzyme / タイプ: protein_or_peptide / ID: 1 詳細: Soluble secreted form of human somatic angiotensin I-converting enzyme terminating at Ser1211 光学異性体: LEVO / EC番号: peptidyl-dipeptidase A |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: LDPGLQPGNF SADEAGAQLF AQSYNSSAEQ V LFQSVAAS WAHDTNITAE NARRQEEAAL LSQEFAEAWG QKAKELYEPI WQNFTDPQLR RI IGAVRTL GSANLPLAKR QQYNALLSNM SRIYSTAKVC LPNKTATCWS LDPDLTNILA SSR SYAMLL FAWEGWHNAA ...文字列: LDPGLQPGNF SADEAGAQLF AQSYNSSAEQ V LFQSVAAS WAHDTNITAE NARRQEEAAL LSQEFAEAWG QKAKELYEPI WQNFTDPQLR RI IGAVRTL GSANLPLAKR QQYNALLSNM SRIYSTAKVC LPNKTATCWS LDPDLTNILA SSR SYAMLL FAWEGWHNAA GIPLKPLYED FTALSNEAYK QDGFTDTGAY WRSWYNSPTF EDDL EHLYQ QLEPLYLNLH AFVRRALHRR YGDRYINLRG PIPAHLLGDM WAQSWENIYD MVVPF PDKP NLDVTSTMLQ QGWNATHMFR VAEEFFTSLE LSPMPPEFWE GSMLEKPADG REVVCH ASA WDFYNRKDFR IKQCTRVTMD QLSTVHHEMG HIQYYLQYKD LPVSLRRGAN PGFHEAI GD VLALSVSTPE HLHKIGLLDR VTNDTESDIN YLLKMALEKI AFLPFGYLVD QWRWGVFS G RTPPSRYNFD WWYLRTKYQG ICPPVTRNET HFDAGAKFHV PNVTPYIRYF VSFVLQFQF HEALCKEAGY EGPLHQCDIY RSTKAGAKLR KVLQAGSSRP WQEVLKDMVG LDALDAQPLL KYFQLVTQW LQEQNQQNGE VLGWPEYQWH PPLPDNYPEG IDLVTDEAEA SKFVEEYDRT S QVVWNEYA EANWNYNTNI TTETSKILLQ KNMQIANHTL KYGTQARKFD VNQLQNTTIK RI IKKVQDL ERAALPAQEL EEYNKILLDM ETTYSVATVC HPNGSCLQLE PDLTNVMATS RKY EDLLWA WEGWRDKAGR AILQFYPKYV ELINQAARLN GYVDAGDSWR SMYETPSLEQ DLER LFQEL QPLYLNLHAY VRRALHRHYG AQHINLEGPI PAHLLGNMWA QTWSNIYDLV VPFPS APSM DTTEAMLKQG WTPRRMFKEA DDFFTSLGLL PVPPEFWNKS MLEKPTDGRE VVCHAS AWD FYNGKDFRIK QCTTVNLEDL VVAHHEMGHI QYFMQYKDLP VALREGANPG FHEAIGD VL ALSVSTPKHL HSLNLLSSEG GSDEHDINFL MKMALDKIAF IPFSYLVDQW RWRVFDGS I TKENYNQEWW SLRLKYQGLC PPVPRTQGDF DPGAKFHIPS SVPYIRYFVS FIIQFQFHE ALCQAAGHTG PLHKCDIYQS KEAGQRLATA MKLGFSRPWP EAMQLITGQP NMSASAMLSY FKPLLDWLR TENELHGEKL GWPQYNWTPN SARSEGPLPD S |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.5 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: Solutions were prepared with deionized water | ||||||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: Diluted protein (in buffer containing zinc chloride and sodium chloride) was incubated on ice for 30 minutes after which it was applied to the grid, incubated for 30 seconds, and blotted for ...詳細: Diluted protein (in buffer containing zinc chloride and sodium chloride) was incubated on ice for 30 minutes after which it was applied to the grid, incubated for 30 seconds, and blotted for 3 seconds before plunging. | ||||||||||||
| 詳細 | The protein was stored at 3.0mg/ml in 50mM HEPES (pH 7.5) and diluted immediately prior to grid preparation |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 1 / 実像数: 11628 / 平均露光時間: 3.0 sec. / 平均電子線量: 43.0 e/Å2 詳細: Images were recorded in super-resolution mode with 40 frames per image |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.8 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 当てはまり具合の基準: Correlation coefficient |
|---|
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)