+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the plectasin fibril (single strand) | |||||||||
 マップデータ マップデータ | single fibril formed by plectasin | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | fibril / helical / ANTIMICROBIAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報potassium channel regulator activity / toxin activity / defense response to bacterium / host cell plasma membrane / extracellular region / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Pseudoplectania nigrella (クロチャワンタケ) Pseudoplectania nigrella (クロチャワンタケ) | |||||||||
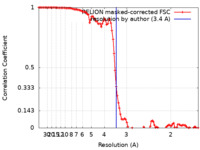
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Effantin G | |||||||||
| 資金援助 | European Union, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: pH- and concentration-dependent supramolecular assembly of a fungal defensin plectasin variant into helical non-amyloid fibrils. 著者: Christin Pohl / Gregory Effantin / Eaazhisai Kandiah / Sebastian Meier / Guanghong Zeng / Werner Streicher / Dorotea Raventos Segura / Per H Mygind / Dorthe Sandvang / Line Anker Nielsen / ...著者: Christin Pohl / Gregory Effantin / Eaazhisai Kandiah / Sebastian Meier / Guanghong Zeng / Werner Streicher / Dorotea Raventos Segura / Per H Mygind / Dorthe Sandvang / Line Anker Nielsen / Günther H J Peters / Guy Schoehn / Christoph Mueller-Dieckmann / Allan Noergaard / Pernille Harris /     要旨: Self-assembly and fibril formation play important roles in protein behaviour. Amyloid fibril formation is well-studied due to its role in neurodegenerative diseases and characterized by refolding of ...Self-assembly and fibril formation play important roles in protein behaviour. Amyloid fibril formation is well-studied due to its role in neurodegenerative diseases and characterized by refolding of the protein into predominantly β-sheet form. However, much less is known about the assembly of proteins into other types of supramolecular structures. Using cryo-electron microscopy at a resolution of 1.97 Å, we show that a triple-mutant of the anti-microbial peptide plectasin, PPI42, assembles into helical non-amyloid fibrils. The in vitro anti-microbial activity was determined and shown to be enhanced compared to the wildtype. Plectasin contains a cysteine-stabilised α-helix-β-sheet structure, which remains intact upon fibril formation. Two protofilaments form a right-handed protein fibril. The fibril formation is reversible and follows sigmoidal kinetics with a pH- and concentration dependent equilibrium between soluble monomer and protein fibril. This high-resolution structure reveals that α/β proteins can natively assemble into fibrils. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12776.map.gz emd_12776.map.gz | 80.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12776-v30.xml emd-12776-v30.xml emd-12776.xml emd-12776.xml | 12.4 KB 12.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12776_fsc.xml emd_12776_fsc.xml | 10.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12776.png emd_12776.png | 84.9 KB | ||
| Filedesc metadata |  emd-12776.cif.gz emd-12776.cif.gz | 5.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12776 http://ftp.pdbj.org/pub/emdb/structures/EMD-12776 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12776 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12776 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12776_validation.pdf.gz emd_12776_validation.pdf.gz | 479.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12776_full_validation.pdf.gz emd_12776_full_validation.pdf.gz | 478.9 KB | 表示 | |
| XML形式データ |  emd_12776_validation.xml.gz emd_12776_validation.xml.gz | 11.8 KB | 表示 | |
| CIF形式データ |  emd_12776_validation.cif.gz emd_12776_validation.cif.gz | 15.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12776 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12776 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12776 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12776 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12776.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12776.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | single fibril formed by plectasin | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.827 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : assembly of plectasin's monomers into a protein fibril
| 全体 | 名称: assembly of plectasin's monomers into a protein fibril |
|---|---|
| 要素 |
|
-超分子 #1: assembly of plectasin's monomers into a protein fibril
| 超分子 | 名称: assembly of plectasin's monomers into a protein fibril タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Pseudoplectania nigrella (クロチャワンタケ) Pseudoplectania nigrella (クロチャワンタケ) |
-分子 #1: Fungal defensin plectasin
| 分子 | 名称: Fungal defensin plectasin / タイプ: protein_or_peptide / ID: 1 / コピー数: 25 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Pseudoplectania nigrella (クロチャワンタケ) Pseudoplectania nigrella (クロチャワンタケ) |
| 分子量 | 理論値: 4.402092 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GFGCNGPWSE DDMKCHNHCK SIKGYKGGYC AKGGFLCKCY UniProtKB: Fungal defensin plectasin |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 5.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー










 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)