+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cooperation between the intrinsically disordered and ordered regions of Spt6 regulates nucleosome and Pol II CTD binding, and nucleosome assembly | |||||||||||||||||||||
 マップデータ マップデータ | Cryosparc sharpened electron density map | |||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
 キーワード キーワード | Spt6 / elongation factor / RNA Pol II / nucleosome / CTD / CHAPERONE | |||||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報transcription antitermination factor activity, DNA binding / regulation of mRNA 3'-end processing / nucleosome organization / poly(A)+ mRNA export from nucleus / transcription elongation-coupled chromatin remodeling / cellular response to stress / nucleosome binding / transcription elongation factor complex / transcription antitermination / positive regulation of transcription elongation by RNA polymerase II ...transcription antitermination factor activity, DNA binding / regulation of mRNA 3'-end processing / nucleosome organization / poly(A)+ mRNA export from nucleus / transcription elongation-coupled chromatin remodeling / cellular response to stress / nucleosome binding / transcription elongation factor complex / transcription antitermination / positive regulation of transcription elongation by RNA polymerase II / transcription elongation by RNA polymerase II / euchromatin / G1/S transition of mitotic cell cycle / nucleosome assembly / histone binding / transcription by RNA polymerase II / chromatin remodeling / negative regulation of transcription by RNA polymerase II / mitochondrion / DNA binding / nucleus 類似検索 - 分子機能 | |||||||||||||||||||||
| 生物種 |  | |||||||||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.71 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Kasiliauskaite A / Kubicek K | |||||||||||||||||||||
| 資金援助 |  チェコ, 6件 チェコ, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2022 ジャーナル: Nucleic Acids Res / 年: 2022タイトル: Cooperation between intrinsically disordered and ordered regions of Spt6 regulates nucleosome and Pol II CTD binding, and nucleosome assembly. 著者: Aiste Kasiliauskaite / Karel Kubicek / Tomas Klumpler / Martina Zanova / David Zapletal / Eliska Koutna / Jiri Novacek / Richard Stefl /  要旨: Transcription elongation factor Spt6 associates with RNA polymerase II (Pol II) and acts as a histone chaperone, which promotes the reassembly of nucleosomes following the passage of Pol II. The ...Transcription elongation factor Spt6 associates with RNA polymerase II (Pol II) and acts as a histone chaperone, which promotes the reassembly of nucleosomes following the passage of Pol II. The precise mechanism of nucleosome reassembly mediated by Spt6 remains unclear. In this study, we used a hybrid approach combining cryo-electron microscopy and small-angle X-ray scattering to visualize the architecture of Spt6 from Saccharomyces cerevisiae. The reconstructed overall architecture of Spt6 reveals not only the core of Spt6, but also its flexible N- and C-termini, which are critical for Spt6's function. We found that the acidic N-terminal region of Spt6 prevents the binding of Spt6 not only to the Pol II CTD and Pol II CTD-linker, but also to pre-formed intact nucleosomes and nucleosomal DNA. The N-terminal region of Spt6 self-associates with the tSH2 domain and the core of Spt6 and thus controls binding to Pol II and nucleosomes. Furthermore, we found that Spt6 promotes the assembly of nucleosomes in vitro. These data indicate that the cooperation between the intrinsically disordered and structured regions of Spt6 regulates nucleosome and Pol II CTD binding, and also nucleosome assembly. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12704.map.gz emd_12704.map.gz | 32.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12704-v30.xml emd-12704-v30.xml emd-12704.xml emd-12704.xml | 21.5 KB 21.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_12704.png emd_12704.png | 76.1 KB | ||
| Filedesc metadata |  emd-12704.cif.gz emd-12704.cif.gz | 7.2 KB | ||
| その他 |  emd_12704_half_map_1.map.gz emd_12704_half_map_1.map.gz emd_12704_half_map_2.map.gz emd_12704_half_map_2.map.gz | 59.5 MB 59.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12704 http://ftp.pdbj.org/pub/emdb/structures/EMD-12704 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12704 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12704 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12704_validation.pdf.gz emd_12704_validation.pdf.gz | 1003 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12704_full_validation.pdf.gz emd_12704_full_validation.pdf.gz | 1002.6 KB | 表示 | |
| XML形式データ |  emd_12704_validation.xml.gz emd_12704_validation.xml.gz | 12.2 KB | 表示 | |
| CIF形式データ |  emd_12704_validation.cif.gz emd_12704_validation.cif.gz | 14.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12704 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12704 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12704 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12704 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7o3dMC  7o6bC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12704.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12704.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryosparc sharpened electron density map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.828 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_12704_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
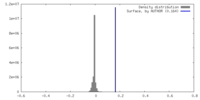
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_12704_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
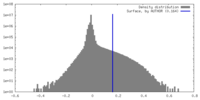
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Structure of elongation factor Spt6
| 全体 | 名称: Structure of elongation factor Spt6 |
|---|---|
| 要素 |
|
-超分子 #1: Structure of elongation factor Spt6
| 超分子 | 名称: Structure of elongation factor Spt6 / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Transcription elongation factor SPT6
| 分子 | 名称: Transcription elongation factor SPT6 / タイプ: protein_or_peptide / ID: 1 詳細: the sequence stretches of the sample that do not make part of the coordinates are flexible regions that were not observed in the cryoEM map コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 134.923031 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GIDPFTDIYD LEDLKKNLMT EGDMKIRKTD IPERYQELRA GITDYGNMSS EDQELERNWI AEKISVDKNF DANYDLTEFK EAIGNAIKF ITKENLEVPF IYAYRRNYIS SREKDGFLLT EDDLWDIVSL DIEFHSLVNK KDYVQRFYAE LHIDDPIVTE Y FKNQNTAS ...文字列: GIDPFTDIYD LEDLKKNLMT EGDMKIRKTD IPERYQELRA GITDYGNMSS EDQELERNWI AEKISVDKNF DANYDLTEFK EAIGNAIKF ITKENLEVPF IYAYRRNYIS SREKDGFLLT EDDLWDIVSL DIEFHSLVNK KDYVQRFYAE LHIDDPIVTE Y FKNQNTAS IAELNSLQDI YDYLEFKYAN EINEMFINHT GKTGKKHLKN SSYEKFKASP LYQAVSDIGI SAEDVGENIS SQ HQIHPPV DHPSSKPVEV IESILNANSG DLQVFTSNTK LAIDTVQKYY SLELSKNTKI REKVRSDFSK YYLADVVLTA KGK KEIQKG SLYEDIKYAI NRTPMHFRRD PDVFLKMVEA ESLNLLSVKL HMSSQAQYIE HLFQIALETT NTSDIAIEWN NFRK LAFNQ AMDKIFQDIS QEVKDNLTKN CQKLVAKTVR HKFMTKLDQA PFIPNVRDPK IPKILSLTCG QGRFGADAII AVYVN RKGD FIRDYKIVDN PFDKTNPEKF EDTLDNIIQS CQPNAIGING PNPKTQKFYK RLQEVLHKKQ IVDSRGHTIP IIYVED EVA IRYQNSERAA QEFPNKPPLV KYCIALARYM HSPLLEYANL TSEEVRSLSI HPHQNLLSSE QLSWALETAF VDIVNLV SV EVNKATDNNY YASALKYISG FGKRKAIDFL QSLQRLNEPL LARQQLITHN ILHKTIFMNS AGFLYISWNE KRQKYEDL E HDQLDSTRIH PEDYHLATKV AADALEYDPD TIAEKEEQGT MSEFIELLRE DPDRRAKLES LNLESYAEEL EKNTGLRKL NNLNTIVLEL LDGFEELRND FHPLQGDEIF QSLTGESEKT FFKGSIIPVR VERFWHNDII CTTNSEVECV VNAQRHAGAQ LRRPANEIY EIGKTYPAKV IYIDYANITA EVSLLDHDVK QQYVPISYSK DPSIWDLKQE LEDAEEERKL MMAEARAKRT H RVINHPYY FPFNGRQAED YLRSKERGEF VIRQSSRGDD HLVITWKLDK DLFQHIDIQE LEKENPLALG KVLIVDNQKY ND LDQIIVE YLQNKVRLLN EMTSSEKFKS GTKKDVVKFI EDYSRVNPNK SVYYFSLNHD NPGWFYLMFK INANSKLYTW NVK LTNTGY FLVNYNYPSV IQLCNGFKTL LKSNSSKNRM NNYR UniProtKB: Transcription elongation factor SPT6 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.15 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 / 構成要素 - 濃度: 20.0 mM / 構成要素 - 式: HEPES / 構成要素 - 名称: HEPES |
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. / 前処理 - 雰囲気: OTHER / 前処理 - 気圧: 0.007 kPa |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | homogeneous monodisperse sample |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3840 pixel / デジタル化 - サイズ - 縦: 3710 pixel / デジタル化 - 画像ごとのフレーム数: 1-40 / 撮影したグリッド数: 1 / 実像数: 13807 / 平均露光時間: 5.0 sec. / 平均電子線量: 55.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 30.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||
|---|---|---|---|---|---|---|---|
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 当てはまり具合の基準: Correlation coefficients | ||||||
| 得られたモデル |  PDB-7o3d: |
 ムービー
ムービー コントローラー
コントローラー






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)