+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1234 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | West Nile virus in complex with the Fab fragment of a neutralizing monoclonal antibody. | |||||||||
 マップデータ マップデータ | map of West Nile Virus complexed with Fab fragment of neutralizing antibody E16 | |||||||||
 試料 試料 |
| |||||||||
| 生物種 | unidentified (未定義) /  West Nile virus (西ナイルウイルス) West Nile virus (西ナイルウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 14.5 Å | |||||||||
 データ登録者 データ登録者 | Kaufmann B / Nybakken GE / Chipman PR / Zhang W / Diamond MS / Fremont DH / Kuhn RJ / Rossmann MG | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2006 ジャーナル: Proc Natl Acad Sci U S A / 年: 2006タイトル: West Nile virus in complex with the Fab fragment of a neutralizing monoclonal antibody. 著者: Bärbel Kaufmann / Grant E Nybakken / Paul R Chipman / Wei Zhang / Michael S Diamond / Daved H Fremont / Richard J Kuhn / Michael G Rossmann /  要旨: Flaviviruses, such as West Nile virus (WNV), are significant human pathogens. The humoral immune response plays an important role in the control of flavivirus infection and disease. The structure of ...Flaviviruses, such as West Nile virus (WNV), are significant human pathogens. The humoral immune response plays an important role in the control of flavivirus infection and disease. The structure of WNV complexed with the Fab fragment of the strongly neutralizing mAb E16 was determined to 14.5-Angstrom resolution with cryo-electron microscopy. E16, an antibody with therapeutic potential, binds to domain III of the WNV envelope glycoprotein. Because of steric hindrance, Fab E16 binds to only 120 of the 180 possible binding sites on the viral surface. Fitting of the previously determined x-ray structure of the Fab-domain III complex into the cryo-electron microscopy density required a change of the elbow angle between the variable and constant domains of the Fab. The structure suggests that the E16 antibody neutralizes WNV by blocking the initial rearrangement of the E glycoprotein before fusion with a cellular membrane. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1234.map.gz emd_1234.map.gz | 32.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1234-v30.xml emd-1234-v30.xml emd-1234.xml emd-1234.xml | 12 KB 12 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1234.gif 1234.gif | 12.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1234 http://ftp.pdbj.org/pub/emdb/structures/EMD-1234 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1234 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1234 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_1234_validation.pdf.gz emd_1234_validation.pdf.gz | 242.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_1234_full_validation.pdf.gz emd_1234_full_validation.pdf.gz | 241.2 KB | 表示 | |
| XML形式データ |  emd_1234_validation.xml.gz emd_1234_validation.xml.gz | 7.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1234 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1234 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1234 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1234 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1234.map.gz / 形式: CCP4 / 大きさ: 101.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1234.map.gz / 形式: CCP4 / 大きさ: 101.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | map of West Nile Virus complexed with Fab fragment of neutralizing antibody E16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.7459 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
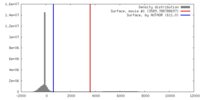
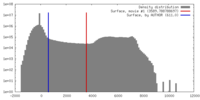
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : West Nile virus NY99 complexed with Fab fragment of neutralizing ...
| 全体 | 名称: West Nile virus NY99 complexed with Fab fragment of neutralizing monoclonal antibody E16 |
|---|---|
| 要素 |
|
-超分子 #1000: West Nile virus NY99 complexed with Fab fragment of neutralizing ...
| 超分子 | 名称: West Nile virus NY99 complexed with Fab fragment of neutralizing monoclonal antibody E16 タイプ: sample / ID: 1000 集合状態: T1 icosahedron with three E monomers and two Fab per asymmetric unit Number unique components: 2 |
|---|
-超分子 #1: West Nile virus
| 超分子 | 名称: West Nile virus / タイプ: virus / ID: 1 / Name.synonym: WNV / NCBI-ID: 11082 / 生物種: West Nile virus / ウイルスタイプ: VIRION / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: Yes / ウイルス・中空状態: No / Syn species name: WNV |
|---|---|
| 宿主 | 生物種:  Homo sapiens (ヒト) / 別称: VERTEBRATES Homo sapiens (ヒト) / 別称: VERTEBRATES |
| ウイルス殻 | Shell ID: 1 / 名称: E glycoprotein / 直径: 500 Å / T番号(三角分割数): 1 |
-分子 #1: E16 Fab fragment
| 分子 | 名称: E16 Fab fragment / タイプ: protein_or_peptide / ID: 1 / コピー数: 120 / 集合状態: Monomer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種: unidentified (未定義) |
| 組換発現 | 生物種: mammalian cell line (unknown) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 / 詳細: 12 mM Tris-HCl, 120 mM NaCl, 1 mM EDTA |
|---|---|
| グリッド | 詳細: 400 mesh copper grid |
| 凍結 | 凍結剤: ETHANE / 装置: HOMEMADE PLUNGER 詳細: Vitrification instrument: Guillotine-style plunge freezeing device 手法: A small vial of ethane is placed inside a larger liquid nitrogen reservoir. The grid holding a few microliters of the sample is held in place at the bottom of a plunger by the means of fine ...手法: A small vial of ethane is placed inside a larger liquid nitrogen reservoir. The grid holding a few microliters of the sample is held in place at the bottom of a plunger by the means of fine tweezers. Once the ethane in the vial is completely frozen, it needs to be slightly melted. When the liquid ethane is ready, a piece of filter paper is then pressed against the sample to blot of excess buffer, sufficient to leave a thin layer on the grid. After a predetermined time, the filter paper is removed, and the plunger is allowed to drop into the liquid ethane. Once the grid enters the liquid ethane, the sample is rapidly frozen, and the grid is transferred under liquid nitrogen to a storage box immersed liquid nitrogen for later use in the microscope. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM300FEG/T |
|---|---|
| 温度 | 平均: 98 K |
| アライメント法 | Legacy - 非点収差: live FFT at 200K mag |
| 詳細 | low dose |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: OTHER / デジタル化 - サンプリング間隔: 6.35 µm / 実像数: 78 / 平均電子線量: 22 e/Å2 / 詳細: Nikon SuperCoolScan 9K scanned images binned 2x2 / ビット/ピクセル: 16 |
| Tilt angle min | 0 |
| Tilt angle max | 0 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 47190 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.88 µm / 最小 デフォーカス(公称値): 1.32 µm / 倍率(公称値): 47000 |
| 試料ステージ | 試料ホルダー: EUCENTRIC / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| 詳細 | The particles were selected interactively at the computer terminal. |
|---|---|
| CTF補正 | 詳細: Each particle |
| 最終 再構成 | 想定した対称性 - 点群: I (正20面体型対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 14.5 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: PFTSEARCH, PO2R, P3DR 詳細: final map includes data to 12.8 Ang resolution (fsc 0.3 cut-off); magnification of final map standardized to a map calculated from dengue virus model coordinates (PDB accession no 1THD) 使用した粒子像数: 3567 |
| 最終 角度割当 | 詳細: theta 69 to 90 degrees phi -31 to 31 degrees omega 0 to 360 degrees |
-原子モデル構築 1
| 初期モデル | PDB ID: |
|---|
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)