+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12324 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | In situ cryo-electron tomogram of the Synechocystis wild-type VIPP1 strain grown in high light | |||||||||
 マップデータ マップデータ | Contrast-enhanced tomogram by deconvolution using the TOM software toolbox (TOMdeconv). This is a binned tomogram at 4x the original pixel size. | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  | |||||||||
| 手法 | 電子線トモグラフィー法 / クライオ電子顕微鏡法 | |||||||||
 データ登録者 データ登録者 | Wietrzynski W / Klumpe S / Heinz S / Spaniol B / Schaffer M / Rast A / Nickelsen J / Schroda M / Engel BD | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2021 ジャーナル: Cell / 年: 2021タイトル: Structural basis for VIPP1 oligomerization and maintenance of thylakoid membrane integrity. 著者: Tilak Kumar Gupta / Sven Klumpe / Karin Gries / Steffen Heinz / Wojciech Wietrzynski / Norikazu Ohnishi / Justus Niemeyer / Benjamin Spaniol / Miroslava Schaffer / Anna Rast / Matthias ...著者: Tilak Kumar Gupta / Sven Klumpe / Karin Gries / Steffen Heinz / Wojciech Wietrzynski / Norikazu Ohnishi / Justus Niemeyer / Benjamin Spaniol / Miroslava Schaffer / Anna Rast / Matthias Ostermeier / Mike Strauss / Jürgen M Plitzko / Wolfgang Baumeister / Till Rudack / Wataru Sakamoto / Jörg Nickelsen / Jan M Schuller / Michael Schroda / Benjamin D Engel /    要旨: Vesicle-inducing protein in plastids 1 (VIPP1) is essential for the biogenesis and maintenance of thylakoid membranes, which transform light into life. However, it is unknown how VIPP1 performs its ...Vesicle-inducing protein in plastids 1 (VIPP1) is essential for the biogenesis and maintenance of thylakoid membranes, which transform light into life. However, it is unknown how VIPP1 performs its vital membrane-remodeling functions. Here, we use cryo-electron microscopy to determine structures of cyanobacterial VIPP1 rings, revealing how VIPP1 monomers flex and interweave to form basket-like assemblies of different symmetries. Three VIPP1 monomers together coordinate a non-canonical nucleotide binding pocket on one end of the ring. Inside the ring's lumen, amphipathic helices from each monomer align to form large hydrophobic columns, enabling VIPP1 to bind and curve membranes. In vivo mutations in these hydrophobic surfaces cause extreme thylakoid swelling under high light, indicating an essential role of VIPP1 lipid binding in resisting stress-induced damage. Using cryo-correlative light and electron microscopy (cryo-CLEM), we observe oligomeric VIPP1 coats encapsulating membrane tubules within the Chlamydomonas chloroplast. Our work provides a structural foundation for understanding how VIPP1 directs thylakoid biogenesis and maintenance. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12324.map.gz emd_12324.map.gz | 642.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12324-v30.xml emd-12324-v30.xml emd-12324.xml emd-12324.xml | 13.6 KB 13.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_12324.png emd_12324.png | 145.7 KB | ||
| その他 |  emd_12324_additional_1.map.gz emd_12324_additional_1.map.gz | 640.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12324 http://ftp.pdbj.org/pub/emdb/structures/EMD-12324 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12324 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12324 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12324_validation.pdf.gz emd_12324_validation.pdf.gz | 204.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12324_full_validation.pdf.gz emd_12324_full_validation.pdf.gz | 203.7 KB | 表示 | |
| XML形式データ |  emd_12324_validation.xml.gz emd_12324_validation.xml.gz | 4.6 KB | 表示 | |
| CIF形式データ |  emd_12324_validation.cif.gz emd_12324_validation.cif.gz | 4.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12324 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12324 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12324 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12324 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12324.map.gz / 形式: CCP4 / 大きさ: 696.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12324.map.gz / 形式: CCP4 / 大きさ: 696.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Contrast-enhanced tomogram by deconvolution using the TOM software toolbox (TOMdeconv). This is a binned tomogram at 4x the original pixel size. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 14.08 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-追加マップ: Original dose-filtered tomogram reconstruction. This is a binned...
| ファイル | emd_12324_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
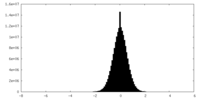
| 注釈 | Original dose-filtered tomogram reconstruction. This is a binned tomogram at 4x the original pixel size. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Synechocystis wild-type VIPP1 strain grown in high light
| 全体 | 名称: Synechocystis wild-type VIPP1 strain grown in high light |
|---|---|
| 要素 |
|
-超分子 #1: Synechocystis wild-type VIPP1 strain grown in high light
| 超分子 | 名称: Synechocystis wild-type VIPP1 strain grown in high light タイプ: cell / ID: 1 / 親要素: 0 |
|---|---|
| 由来(天然) | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 電子線トモグラフィー法 |
| 試料の集合状態 | cell |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE-PROPANE / 装置: FEI VITROBOT MARK IV |
| 切片作成 | 集束イオンビーム - 装置: OTHER / 集束イオンビーム - イオン: OTHER / 集束イオンビーム - 電圧: 30 kV / 集束イオンビーム - 電流: 0.03 nA / 集束イオンビーム - 時間: 1800 sec. / 集束イオンビーム - 温度: 91 K / 集束イオンビーム - Initial thickness: 3000 nm / 集束イオンビーム - 最終 厚さ: 200 nm 集束イオンビーム - 詳細: See https://bio-protocol.org/e1575 for detailed procedure.. The value given for _emd_sectioning_focused_ion_beam.instrument is FEI Aquilos FIB. This is not in a ...集束イオンビーム - 詳細: See https://bio-protocol.org/e1575 for detailed procedure.. The value given for _emd_sectioning_focused_ion_beam.instrument is FEI Aquilos FIB. This is not in a list of allowed values {'OTHER', 'DB235'} so OTHER is written into the XML file. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 詳細 | Dose-symmetric tilt-series were acquired (Hagen et al., 2017), starting at +10 degrees to match the pre-tilt of the lamella (i.e. from -50 to +70 degrees). |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均露光時間: 1.0 sec. / 平均電子線量: 2.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 5.5 µm / 最小 デフォーカス(公称値): 4.0 µm / 倍率(公称値): 42000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | アルゴリズム: BACK PROJECTION / ソフトウェア - 名称:  IMOD / 使用した粒子像数: 61 IMOD / 使用した粒子像数: 61 |
|---|---|
| CTF補正 | ソフトウェア - 名称:  IMOD IMOD |
 ムービー
ムービー コントローラー
コントローラー




















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)