+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11628 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Distance-dependent synaptic vesicle protein organisation. | |||||||||||||||
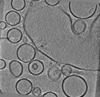
 マップデータ マップデータ | Tomogram from delta-84 Munc-18 condition. | |||||||||||||||
 試料 試料 |
| |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 電子線トモグラフィー法 / クライオ電子顕微鏡法 | |||||||||||||||
 データ登録者 データ登録者 | Ginger L / Malsam J / Sonnen AF-P / Morado D / Scheutzow A / Sollner TH / Briggs JAG | |||||||||||||||
| 資金援助 |  英国, 英国,  ドイツ, 4件 ドイツ, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: FEBS Lett / 年: 2020 ジャーナル: FEBS Lett / 年: 2020タイトル: Arrangements of proteins at reconstituted synaptic vesicle fusion sites depend on membrane separation. 著者: Lucy Ginger / Joerg Malsam / Andreas F-P Sonnen / Dustin Morado / Andrea Scheutzow / Thomas H Söllner / John A G Briggs /   要旨: Synaptic vesicle proteins, including N-ethylmaleimide-sensitive factor attachment protein receptors (SNAREs), Synaptotagmin-1 and Complexin, are responsible for controlling the synchronised fusion of ...Synaptic vesicle proteins, including N-ethylmaleimide-sensitive factor attachment protein receptors (SNAREs), Synaptotagmin-1 and Complexin, are responsible for controlling the synchronised fusion of synaptic vesicles with the presynaptic plasma membrane in response to elevated cytosolic calcium levels. A range of structures of SNAREs and their regulatory proteins have been elucidated, but the exact organisation of these proteins at synaptic junction membranes remains elusive. Here, we have used cryoelectron tomography to investigate the arrangement of synaptic proteins in an in vitro reconstituted fusion system. We found that the separation between vesicle and target membranes strongly correlates with the organisation of protein complexes at junctions. At larger membrane separations, protein complexes assume a 'clustered' distribution at the docking site, inducing a protrusion in the target membrane. As the membrane separation decreases, protein complexes become displaced radially outwards and assume a 'ring-like' arrangement. Our findings indicate that docked vesicles can possess a wide range of protein complex numbers and be heterogeneous in their protein arrangements. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11628.map.gz emd_11628.map.gz | 1.2 GB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11628-v30.xml emd-11628-v30.xml emd-11628.xml emd-11628.xml | 9.9 KB 9.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_11628.png emd_11628.png | 142.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11628 http://ftp.pdbj.org/pub/emdb/structures/EMD-11628 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11628 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11628 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11628_validation.pdf.gz emd_11628_validation.pdf.gz | 168.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11628_full_validation.pdf.gz emd_11628_full_validation.pdf.gz | 168 KB | 表示 | |
| XML形式データ |  emd_11628_validation.xml.gz emd_11628_validation.xml.gz | 5.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11628 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11628 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11628 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11628 | HTTPS FTP |
-関連構造データ
| 電子顕微鏡画像生データ |  EMPIAR-10498 (タイトル: Arrangements of proteins at reconstituted synaptic vesicle fusion sites depend on membrane separation. EMPIAR-10498 (タイトル: Arrangements of proteins at reconstituted synaptic vesicle fusion sites depend on membrane separation.Data size: 70.0 Data #1: Tomograms from the delta84 + Munc-18 condition and associated coordinate file. [reconstructed volumes] Data #2: Tomograms from the delta84 condition (collection 1) and associated coordinate file. [reconstructed volumes] Data #3: Tomograms from the delta84 condition (collection 2) and associated coordinate file. [reconstructed volumes] Data #4: Tomograms from the WT condition and associated coordinate file. [reconstructed volumes]) |
|---|
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11628.map.gz / 形式: CCP4 / 大きさ: 1.3 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11628.map.gz / 形式: CCP4 / 大きさ: 1.3 GB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Tomogram from delta-84 Munc-18 condition. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.356 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Synaptic membrane fusion reconstituted in vitro
| 全体 | 名称: Synaptic membrane fusion reconstituted in vitro |
|---|---|
| 要素 |
|
-超分子 #1: Synaptic membrane fusion reconstituted in vitro
| 超分子 | 名称: Synaptic membrane fusion reconstituted in vitro / タイプ: complex / ID: 1 / 親要素: 0 詳細: Synaptic membrane fusion reconstituted in vitro by mixing: giant unilamellar vesicles reconstituted with t-SNARE complex proteins; small unilamellar vesicles reconstituted with v-SNARE and ...詳細: Synaptic membrane fusion reconstituted in vitro by mixing: giant unilamellar vesicles reconstituted with t-SNARE complex proteins; small unilamellar vesicles reconstituted with v-SNARE and Synaptotagmin-1; Complexin-II and Munc-18. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 電子線トモグラフィー法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
| 切片作成 | その他: NO SECTIONING |
| 位置合わせマーカー | Manufacturer: BBI Solutions / 直径: 10 nm |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | 位相板: VOLTA PHASE PLATE / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 平均電子線量: 1.6 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 0.0 µm / 最小 デフォーカス(公称値): 0.0 µm / 倍率(公称値): 81000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | アルゴリズム: BACK PROJECTION / 使用した粒子像数: 121 |
|---|
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)