+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-0314 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of McrBC without DNA binding domains (Class 4) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | AAA+ superfamily / restriction enzyme / DNA BINDING PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報type IV site-specific deoxyribonuclease activity / restriction endodeoxyribonuclease activity / endonuclease complex / double-stranded methylated DNA binding / hemi-methylated DNA-binding / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ / DNA catabolic process / DNA restriction-modification system / endonuclease activity / GTPase activity ...type IV site-specific deoxyribonuclease activity / restriction endodeoxyribonuclease activity / endonuclease complex / double-stranded methylated DNA binding / hemi-methylated DNA-binding / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ / DNA catabolic process / DNA restriction-modification system / endonuclease activity / GTPase activity / GTP binding / ATP hydrolysis activity / DNA binding / ATP binding / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
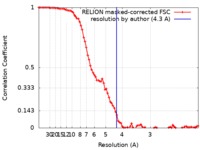
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.3 Å | |||||||||
 データ登録者 データ登録者 | Itoh Y / Nirwan N | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2019 ジャーナル: Nat Commun / 年: 2019タイトル: Structure-based mechanism for activation of the AAA+ GTPase McrB by the endonuclease McrC. 著者: Neha Nirwan / Yuzuru Itoh / Pratima Singh / Sutirtha Bandyopadhyay / Kutti R Vinothkumar / Alexey Amunts / Kayarat Saikrishnan /    要旨: The AAA+ GTPase McrB powers DNA cleavage by the endonuclease McrC. The GTPase itself is activated by McrC. The architecture of the GTPase and nuclease complex, and the mechanism of their activation ...The AAA+ GTPase McrB powers DNA cleavage by the endonuclease McrC. The GTPase itself is activated by McrC. The architecture of the GTPase and nuclease complex, and the mechanism of their activation remained unknown. Here, we report a 3.6 Å structure of a GTPase-active and DNA-binding deficient construct of McrBC. Two hexameric rings of McrB are bridged by McrC dimer. McrC interacts asymmetrically with McrB protomers and inserts a stalk into the pore of the ring, reminiscent of the γ subunit complexed to αβ of F-ATPase. Activation of the GTPase involves conformational changes of residues essential for hydrolysis. Three consecutive nucleotide-binding pockets are occupied by the GTP analogue 5'-guanylyl imidodiphosphate and the next three by GDP, which is suggestive of sequential GTP hydrolysis. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
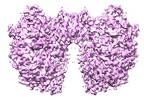
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0314.map.gz emd_0314.map.gz | 7.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0314-v30.xml emd-0314-v30.xml emd-0314.xml emd-0314.xml | 20 KB 20 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0314_fsc.xml emd_0314_fsc.xml | 8.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0314.png emd_0314.png | 315.5 KB | ||
| マスクデータ |  emd_0314_msk_1.map emd_0314_msk_1.map | 52.7 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-0314.cif.gz emd-0314.cif.gz | 6.7 KB | ||
| その他 |  emd_0314_half_map_1.map.gz emd_0314_half_map_1.map.gz emd_0314_half_map_2.map.gz emd_0314_half_map_2.map.gz | 39.7 MB 39.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0314 http://ftp.pdbj.org/pub/emdb/structures/EMD-0314 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0314 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0314 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_0314_validation.pdf.gz emd_0314_validation.pdf.gz | 430.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_0314_full_validation.pdf.gz emd_0314_full_validation.pdf.gz | 430.1 KB | 表示 | |
| XML形式データ |  emd_0314_validation.xml.gz emd_0314_validation.xml.gz | 14.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0314 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0314 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0314 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0314 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6hz8MC  0310C  0311C  0312C  0313C  0315C  6hz4C  6hz5C  6hz6C  6hz7C  6hz9C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0314.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0314.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.05 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
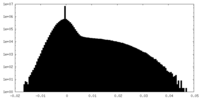
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_0314_msk_1.map emd_0314_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
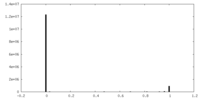
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_0314_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
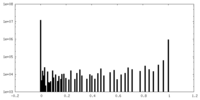
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_0314_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
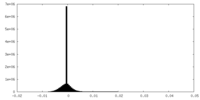
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : McrB and McrC complex without DNA binding domains
| 全体 | 名称: McrB and McrC complex without DNA binding domains |
|---|---|
| 要素 |
|
-超分子 #1: McrB and McrC complex without DNA binding domains
| 超分子 | 名称: McrB and McrC complex without DNA binding domains / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 詳細: The N-terminal DNA binding domain of McrB is truncated |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 510 KDa |
-分子 #1: 5-methylcytosine-specific restriction enzyme B
| 分子 | 名称: 5-methylcytosine-specific restriction enzyme B / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO EC番号: 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 35.758492 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSKTESYCLE DALNDLFIPE TTIETILKRL TIKKNIILQG PPGVGKTFVA RRLAYLLTGE KAPQRVNMVQ FHQSYSYEDF IQGYRPNGV GFRRKDGIFY NFCQQAKEQP EKKYIFIIDE INRANLSKVF GEVMMLMEHD KRGENWSVPL TYSENDEERF Y VPENVYII ...文字列: MSKTESYCLE DALNDLFIPE TTIETILKRL TIKKNIILQG PPGVGKTFVA RRLAYLLTGE KAPQRVNMVQ FHQSYSYEDF IQGYRPNGV GFRRKDGIFY NFCQQAKEQP EKKYIFIIDE INRANLSKVF GEVMMLMEHD KRGENWSVPL TYSENDEERF Y VPENVYII GLMNTADRSL AVVDYALRRR FSFIDIEPGF DTPQFRNFLL NKKAEPSFVE SLCQKMNELN QEISKEATIL GK GFRIGHS YFCCGLEDGT SPDTQWLNEI VMTDIAPLLE EYFFDDPYKQ QKWTNKLLGD SSGSHHHHHH UniProtKB: Type IV methyl-directed restriction enzyme EcoKMcrB subunit |
-分子 #2: Protein McrC
| 分子 | 名称: Protein McrC / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 40.643625 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MEQPVIPVRN IYYMLTYAWG YLQEIKQANL EAIPGNNLLD ILGYVLNKGV LQLSRRGLEL DYNPNTEIIP GIKGRIEFAK TIRGFHLNH GKTVSTFDML NEDTLANRII KSTLAILIKH EKLNSTIRDE ARSLYRKLPG ISTLHLTPQH FSYLNGGKNT R YYKFVISV ...文字列: MEQPVIPVRN IYYMLTYAWG YLQEIKQANL EAIPGNNLLD ILGYVLNKGV LQLSRRGLEL DYNPNTEIIP GIKGRIEFAK TIRGFHLNH GKTVSTFDML NEDTLANRII KSTLAILIKH EKLNSTIRDE ARSLYRKLPG ISTLHLTPQH FSYLNGGKNT R YYKFVISV CKFIVNNSIP GQNKGHYRFY DFERNEKEMS LLYQKFLYEF CRRELTSANT TRSYLKWDAS SISDQSLNLL PR METDITI RSSEKILIVD AKYYKSIFSR RMGTEKFHSQ NLYQLMNYLW SLKPENGENI GGLLIYPHVD TAVKHRYKIN GFD IGLCTV NLGQEWPCIH QELLDIFDEY LK UniProtKB: Type IV methyl-directed restriction enzyme EcoKMcrBC |
-分子 #3: PHOSPHOAMINOPHOSPHONIC ACID-GUANYLATE ESTER
| 分子 | 名称: PHOSPHOAMINOPHOSPHONIC ACID-GUANYLATE ESTER / タイプ: ligand / ID: 3 / コピー数: 6 / 式: GNP |
|---|---|
| 分子量 | 理論値: 522.196 Da |
| Chemical component information |  ChemComp-GNP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 6 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #5: GUANOSINE-5'-DIPHOSPHATE
| 分子 | 名称: GUANOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 6 / 式: GDP |
|---|---|
| 分子量 | 理論値: 443.201 Da |
| Chemical component information |  ChemComp-GDP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4.0 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 2-20 / 撮影したグリッド数: 1 / 実像数: 3326 / 平均露光時間: 8.0 sec. / 平均電子線量: 1.5 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 最大 デフォーカス(補正後): 5.0 µm / 最小 デフォーカス(補正後): 0.3 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 74 当てはまり具合の基準: Cross-correlation coefficient |
|---|---|
| 得られたモデル |  PDB-6hz8: |
 ムービー
ムービー コントローラー
コントローラー







 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)