+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8usq | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
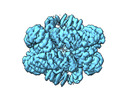
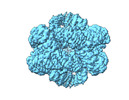
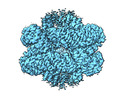
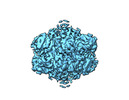
| タイトル | Structural and biochemical investigations of a HEAT-repeat protein involved in the cytosolic iron-sulfur cluster assembly pathway | |||||||||||||||
 要素 要素 | DNA repair/transcription protein MET18/MMS19 | |||||||||||||||
 キーワード キーワード | METAL TRANSPORT / IRON-SULFUR CLUSTER / METALLOCOFACTOR / ASSEMBLY | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytosolic [4Fe-4S] assembly targeting complex / protein maturation by iron-sulfur cluster transfer / MMXD complex / iron-sulfur cluster assembly / DNA metabolic process / response to UV / : / DNA repair / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  | |||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 12.77 Å | |||||||||||||||
 データ登録者 データ登録者 | Vasquez, S. / Drennan, C.L. | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2023 ジャーナル: Commun Biol / 年: 2023タイトル: Structural and biochemical investigations of a HEAT-repeat protein involved in the cytosolic iron-sulfur cluster assembly pathway. 著者: Sheena Vasquez / Melissa D Marquez / Edward J Brignole / Amanda Vo / Sunnie Kong / Christopher Park / Deborah L Perlstein / Catherine L Drennan /  要旨: Iron-sulfur clusters are essential for life and defects in their biosynthesis lead to human diseases. The mechanism of cluster assembly and delivery to cytosolic and nuclear client proteins via the ...Iron-sulfur clusters are essential for life and defects in their biosynthesis lead to human diseases. The mechanism of cluster assembly and delivery to cytosolic and nuclear client proteins via the cytosolic iron-sulfur cluster assembly (CIA) pathway is not well understood. Here we report cryo-EM structures of the HEAT-repeat protein Met18 from Saccharomyces cerevisiae, a key component of the CIA targeting complex (CTC) that identifies cytosolic and nuclear client proteins and delivers a mature iron-sulfur cluster. We find that in the absence of other CTC proteins, Met18 adopts tetrameric and hexameric states. Using mass photometry and negative stain EM, we show that upon the addition of Cia2, these higher order oligomeric states of Met18 disassemble. We also use pulldown assays to identify residues of critical importance for Cia2 binding and recognition of the Leu1 client, many of which are buried when Met18 oligomerizes. Our structures show conformations of Met18 that have not been previously observed in any Met18 homolog, lending support to the idea that a highly flexible Met18 may be key to how the CTC is able to deliver iron-sulfur clusters to client proteins of various sizes and shapes, i.e. Met18 conforms to the dimensions needed. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8usq.cif.gz 8usq.cif.gz | 702.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8usq.ent.gz pdb8usq.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8usq.json.gz 8usq.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8usq_validation.pdf.gz 8usq_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8usq_full_validation.pdf.gz 8usq_full_validation.pdf.gz | 1.4 MB | 表示 | |
| XML形式データ |  8usq_validation.xml.gz 8usq_validation.xml.gz | 113 KB | 表示 | |
| CIF形式データ |  8usq_validation.cif.gz 8usq_validation.cif.gz | 171.1 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/us/8usq https://data.pdbj.org/pub/pdb/validation_reports/us/8usq ftp://data.pdbj.org/pub/pdb/validation_reports/us/8usq ftp://data.pdbj.org/pub/pdb/validation_reports/us/8usq | HTTPS FTP |
-関連構造データ
| 関連構造データ |  42511MC  8uspC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
| #1: タンパク質 | 分子量: 118007.078 Da / 分子数: 4 / 由来タイプ: 組換発現 由来: (組換発現)  株: ATCC 204508 / S288C / 遺伝子: MET18 / 発現宿主:  |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: QUATERNARY COMPLEX OF MET18 TETRAMER / タイプ: COMPLEX / 詳細: MET18 TETRAMER IMAGED AND SOLVED BY CRYO-EM. / Entity ID: all / 由来: RECOMBINANT | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 118 kDa/nm / 実験値: YES | ||||||||||||||||||||
| 由来(天然) | 生物種:  | ||||||||||||||||||||
| 由来(組換発現) | 生物種:  | ||||||||||||||||||||
| 緩衝液 | pH: 8 | ||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||
| 試料 | 濃度: 2 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||||||||||
| 試料支持 | グリッドの材料: COPPER | ||||||||||||||||||||
| 急速凍結 | 凍結剤: ETHANE / 湿度: 77 % / 凍結前の試料温度: 297.15 K / 詳細: SAMPLE WAS PREPARED ON THE CHAMELEON |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TECNAI ARCTICA |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(補正後): 92000 X / 最大 デフォーカス(公称値): 3400 nm / 最小 デフォーカス(公称値): 1300 nm / Cs: 2.7 mm |
| 試料ホルダ | 凍結剤: NITROGEN |
| 撮影 | 電子線照射量: 53.47 e/Å2 フィルム・検出器のモデル: FEI FALCON III (4k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: NONE | ||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 139569 | ||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 12.77 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 30104 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: AB INITIO MODEL / 空間: REAL | ||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6tc0 Accession code: 6tc0 / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||||||||||
| 精密化 | 最高解像度: 12.77 Å |
 ムービー
ムービー コントローラー
コントローラー



 PDBj
PDBj
