+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8pmj | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Vanadate-trapped BSEP in nanodiscs | ||||||||||||
 要素 要素 | Bile salt export pump | ||||||||||||
 キーワード キーワード | PROTEIN TRANSPORT / Transport / Nucleotide / Vanadate / Nanodiscs | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報canalicular bile acid transmembrane transporter activity / positive regulation of bile acid secretion / Defective ABCB11 causes PFIC2 and BRIC2 / canalicular bile acid transport / intracellular canaliculus / xenobiotic export from cell / regulation of fatty acid beta-oxidation / regulation of bile acid metabolic process / ABC-type bile acid transporter activity / bile acid signaling pathway ...canalicular bile acid transmembrane transporter activity / positive regulation of bile acid secretion / Defective ABCB11 causes PFIC2 and BRIC2 / canalicular bile acid transport / intracellular canaliculus / xenobiotic export from cell / regulation of fatty acid beta-oxidation / regulation of bile acid metabolic process / ABC-type bile acid transporter activity / bile acid signaling pathway / bile acid biosynthetic process / xenobiotic transmembrane transport / bile acid transmembrane transporter activity / phospholipid homeostasis / intercellular canaliculus / bile acid metabolic process / トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う / ABC-type xenobiotic transporter activity / bile acid and bile salt transport / lipid homeostasis / carbohydrate transmembrane transporter activity / Synthesis of bile acids and bile salts via 7alpha-hydroxycholesterol / Recycling of bile acids and salts / xenobiotic metabolic process / cholesterol homeostasis / fatty acid metabolic process / recycling endosome / response to organic cyclic compound / transmembrane transport / response to estrogen / recycling endosome membrane / response to ethanol / response to oxidative stress / endosome / protein ubiquitination / apical plasma membrane / Golgi membrane / cell surface / ATP hydrolysis activity / extracellular exosome / ATP binding / membrane / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.81 Å | ||||||||||||
 データ登録者 データ登録者 | Liu, H. / Irobalieva, R.N. / Kowal, J. / Ni, D. / Nosol, K. / Bang-Sorensen, R. / Lancien, L. / Stahlberg, H. / Stieger, B. / Locher, K.P. | ||||||||||||
| 資金援助 |  スイス, 3件 スイス, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Structural basis of bile salt extrusion and small-molecule inhibition in human BSEP. 著者: Hongtao Liu / Rossitza N Irobalieva / Julia Kowal / Dongchun Ni / Kamil Nosol / Rose Bang-Sørensen / Loïck Lancien / Henning Stahlberg / Bruno Stieger / Kaspar P Locher /  要旨: BSEP (ABCB11) is an ATP-binding cassette transporter that is expressed in hepatocytes and extrudes bile salts into the canaliculi of the liver. BSEP dysfunction, caused by mutations or induced by ...BSEP (ABCB11) is an ATP-binding cassette transporter that is expressed in hepatocytes and extrudes bile salts into the canaliculi of the liver. BSEP dysfunction, caused by mutations or induced by drugs, is frequently associated with severe cholestatic liver disease. We report the cryo-EM structure of glibenclamide-bound human BSEP in nanodiscs, revealing the basis of small-molecule inhibition. Glibenclamide binds the apex of a central binding pocket between the transmembrane domains, preventing BSEP from undergoing conformational changes, and thus rationalizing the reduced uptake of bile salts. We further report two high-resolution structures of BSEP trapped in distinct nucleotide-bound states by using a catalytically inactivated BSEP variant (BSEP) to visualize a pre-hydrolysis state, and wild-type BSEP trapped by vanadate to visualize a post-hydrolysis state. Our studies provide structural and functional insight into the mechanism of bile salt extrusion and into small-molecule inhibition of BSEP, which may rationalize drug-induced liver toxicity. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8pmj.cif.gz 8pmj.cif.gz | 242.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8pmj.ent.gz pdb8pmj.ent.gz | 188.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8pmj.json.gz 8pmj.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8pmj_validation.pdf.gz 8pmj_validation.pdf.gz | 1.7 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8pmj_full_validation.pdf.gz 8pmj_full_validation.pdf.gz | 1.7 MB | 表示 | |
| XML形式データ |  8pmj_validation.xml.gz 8pmj_validation.xml.gz | 44.1 KB | 表示 | |
| CIF形式データ |  8pmj_validation.cif.gz 8pmj_validation.cif.gz | 63.4 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pm/8pmj https://data.pdbj.org/pub/pdb/validation_reports/pm/8pmj ftp://data.pdbj.org/pub/pdb/validation_reports/pm/8pmj ftp://data.pdbj.org/pub/pdb/validation_reports/pm/8pmj | HTTPS FTP |
-関連構造データ
| 関連構造データ |  17761MC  8pm6C  8pmdC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 1種, 1分子 A
| #1: タンパク質 | 分子量: 146557.391 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ABCB11, BSEP / 発現宿主: Homo sapiens (ヒト) / 遺伝子: ABCB11, BSEP / 発現宿主:  Homo sapiens (ヒト) Homo sapiens (ヒト)参照: UniProt: O95342, トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う |
|---|
-非ポリマー , 6種, 12分子 


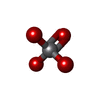







| #2: 化合物 | ChemComp-ATP / | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| #3: 化合物 | ChemComp-CLR / #4: 化合物 | ChemComp-ADP / | #5: 化合物 | ChemComp-VO4 / | #6: 化合物 | #7: 水 | ChemComp-HOH / | |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Vanadate-trapped BSEP in nanodiscs / タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT |
|---|---|
| 分子量 | 値: 0.146 MDa / 実験値: YES |
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE-PROPANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2400 nm / 最小 デフォーカス(公称値): 600 nm / Cs: 2.7 mm |
| 試料ホルダ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 66 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3次元再構成 | 解像度: 2.81 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 155199 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー





 PDBj
PDBj

















