+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8pk9 | ||||||
|---|---|---|---|---|---|---|---|
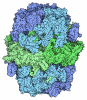
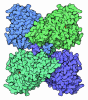
| タイトル | Structure of the human mitochondrial iron-sulfur cluster biosynthesis complex during persulfide transfer (persulfide on NFS1 and ISCU2) | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | TRANSFERASE / cysteine desulfurase / FeS biosynthesis / FeS biogenesis / mitochondria / Friedreich's ataxia / persulfide / frataxin | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報iron-sulfur cluster chaperone activity / negative regulation of iron ion import across plasma membrane / molybdopterin cofactor metabolic process / proprioception / Molybdenum cofactor biosynthesis / positive regulation of lyase activity / L-cysteine desulfurase complex / [4Fe-4S] cluster assembly / Mitochondrial iron-sulfur cluster biogenesis / Complex III assembly ...iron-sulfur cluster chaperone activity / negative regulation of iron ion import across plasma membrane / molybdopterin cofactor metabolic process / proprioception / Molybdenum cofactor biosynthesis / positive regulation of lyase activity / L-cysteine desulfurase complex / [4Fe-4S] cluster assembly / Mitochondrial iron-sulfur cluster biogenesis / Complex III assembly / sulfur carrier activity / iron chaperone activity / positive regulation of mitochondrial electron transport, NADH to ubiquinone / Maturation of TCA enzymes and regulation of TCA cycle / negative regulation of organ growth / cysteine desulfurase / cysteine desulfurase activity / mitochondrial respiratory chain complex III assembly / Mo-molybdopterin cofactor biosynthetic process / Mitochondrial protein import / embryo development ending in birth or egg hatching / mitochondrial [2Fe-2S] assembly complex / iron-sulfur cluster assembly complex / oxidative phosphorylation / response to iron ion / [2Fe-2S] cluster assembly / adult walking behavior / heme biosynthetic process / organ growth / negative regulation of multicellular organism growth / lipid A biosynthetic process / muscle cell cellular homeostasis / iron-sulfur cluster assembly / lipid biosynthetic process / acyl binding / ferroxidase / negative regulation of release of cytochrome c from mitochondria / acyl carrier activity / ferroxidase activity / protein autoprocessing / iron-sulfur cluster binding / phosphopantetheine binding / ferric iron binding / protein maturation / enzyme activator activity / ferrous iron binding / 2 iron, 2 sulfur cluster binding / cellular response to hydrogen peroxide / fatty acid biosynthetic process / pyridoxal phosphate binding / iron ion transport / Maturation of replicase proteins / molecular adaptor activity / intracellular iron ion homeostasis / nuclear body / mitochondrial matrix / iron ion binding / response to xenobiotic stimulus / lipid binding / centrosome / negative regulation of apoptotic process / structural molecule activity / protein homodimerization activity / mitochondrion / zinc ion binding / nucleoplasm / metal ion binding / nucleus / membrane / cytosol / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.58 Å | ||||||
 データ登録者 データ登録者 | Steinhilper, R. / Murphy, B.J. | ||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Mechanism and structural dynamics of sulfur transfer during de novo [2Fe-2S] cluster assembly on ISCU2. 著者: Vinzent Schulz / Ralf Steinhilper / Jonathan Oltmanns / Sven-A Freibert / Nils Krapoth / Uwe Linne / Sonja Welsch / Maren H Hoock / Volker Schünemann / Bonnie J Murphy / Roland Lill /  要旨: Maturation of iron-sulfur proteins in eukaryotes is initiated in mitochondria by the core iron-sulfur cluster assembly (ISC) complex, consisting of the cysteine desulfurase sub-complex NFS1-ISD11- ...Maturation of iron-sulfur proteins in eukaryotes is initiated in mitochondria by the core iron-sulfur cluster assembly (ISC) complex, consisting of the cysteine desulfurase sub-complex NFS1-ISD11-ACP1, the scaffold protein ISCU2, the electron donor ferredoxin FDX2, and frataxin, a protein dysfunctional in Friedreich's ataxia. The core ISC complex synthesizes [2Fe-2S] clusters de novo from Fe and a persulfide (SSH) bound at conserved cluster assembly site residues. Here, we elucidate the poorly understood Fe-dependent mechanism of persulfide transfer from cysteine desulfurase NFS1 to ISCU2. High-resolution cryo-EM structures obtained from anaerobically prepared samples provide snapshots that both visualize different stages of persulfide transfer from Cys381 to Cys138 and clarify the molecular role of frataxin in optimally positioning assembly site residues for fast sulfur transfer. Biochemical analyses assign ISCU2 residues essential for sulfur transfer, and reveal that Cys138 rapidly receives the persulfide without a detectable intermediate. Mössbauer spectroscopy assessing the Fe coordination of various sulfur transfer intermediates shows a dynamic equilibrium between pre- and post-sulfur-transfer states shifted by frataxin. Collectively, our study defines crucial mechanistic stages of physiological [2Fe-2S] cluster assembly and clarifies frataxin's molecular role in this fundamental process. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8pk9.cif.gz 8pk9.cif.gz | 196.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8pk9.ent.gz pdb8pk9.ent.gz | 142.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8pk9.json.gz 8pk9.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8pk9_validation.pdf.gz 8pk9_validation.pdf.gz | 1.2 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8pk9_full_validation.pdf.gz 8pk9_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  8pk9_validation.xml.gz 8pk9_validation.xml.gz | 33 KB | 表示 | |
| CIF形式データ |  8pk9_validation.cif.gz 8pk9_validation.cif.gz | 50.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/pk/8pk9 https://data.pdbj.org/pub/pdb/validation_reports/pk/8pk9 ftp://data.pdbj.org/pub/pdb/validation_reports/pk/8pk9 ftp://data.pdbj.org/pub/pdb/validation_reports/pk/8pk9 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  17733MC  8pk8C  8pkaC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 5種, 5分子 ABCDE
| #1: タンパク質 | 分子量: 44969.516 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: NFS1, NIFS, HUSSY-08 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: NFS1, NIFS, HUSSY-08 / 発現宿主:  |
|---|---|
| #2: タンパク質 | 分子量: 13502.373 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: LYRM4, C6orf149, ISD11, CGI-203 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: LYRM4, C6orf149, ISD11, CGI-203 / 発現宿主:  |
| #3: タンパク質 | 分子量: 8645.460 Da / 分子数: 1 / 由来タイプ: 天然 / 由来: (天然)  |
| #4: タンパク質 | 分子量: 15716.184 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: ISCU, NIFUN / 発現宿主: Homo sapiens (ヒト) / 遺伝子: ISCU, NIFUN / 発現宿主:  |
| #5: タンパク質 | 分子量: 14554.985 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: FXN, FRDA, X25 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FXN, FRDA, X25 / 発現宿主:  |
-非ポリマー , 4種, 102分子 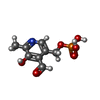






| #6: 化合物 | ChemComp-PLP / |
|---|---|
| #7: 化合物 | ChemComp-8Q1 / |
| #8: 化合物 | ChemComp-FE2 / |
| #9: 水 | ChemComp-HOH / |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Iron-bound human NFS1-ISD11-ACP1-ISCU2-FXN (Fe-NIAUX) complex during persulfide transfer タイプ: COMPLEX / Entity ID: #1-#5 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.4 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: TFS KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 800 nm |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 電子線照射量: 62 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.58 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 393707 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 6NZU Accession code: 6NZU / Source name: PDB / タイプ: experimental model | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj