+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7xcr | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
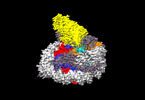
| タイトル | Cryo-EM structure of Dot1L and H2BK34ub-H3K79Nle nucleosome 1:1 complex | ||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||
 キーワード キーワード | NUCLEAR PROTEIN / Complex / Dot1L / H2BK34ub / Nucleosome | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報histone H3K79 trimethyltransferase activity / [histone H3]-lysine79 N-trimethyltransferase / histone H3K79 methyltransferase activity / regulation of transcription regulatory region DNA binding / hypothalamus gonadotrophin-releasing hormone neuron development / histone H3 methyltransferase activity / female meiosis I / regulation of receptor signaling pathway via JAK-STAT / positive regulation of protein monoubiquitination / mitochondrion transport along microtubule ...histone H3K79 trimethyltransferase activity / [histone H3]-lysine79 N-trimethyltransferase / histone H3K79 methyltransferase activity / regulation of transcription regulatory region DNA binding / hypothalamus gonadotrophin-releasing hormone neuron development / histone H3 methyltransferase activity / female meiosis I / regulation of receptor signaling pathway via JAK-STAT / positive regulation of protein monoubiquitination / mitochondrion transport along microtubule / fat pad development / histone methyltransferase activity / female gonad development / seminiferous tubule development / male meiosis I / positive regulation of intrinsic apoptotic signaling pathway by p53 class mediator / Replacement of protamines by nucleosomes in the male pronucleus / heterochromatin formation / energy homeostasis / regulation of neuron apoptotic process / Packaging Of Telomere Ends / regulation of proteasomal protein catabolic process / Recognition and association of DNA glycosylase with site containing an affected purine / Cleavage of the damaged purine / Maturation of protein E / Deposition of new CENPA-containing nucleosomes at the centromere / Maturation of protein E / ER Quality Control Compartment (ERQC) / Myoclonic epilepsy of Lafora / FLT3 signaling by CBL mutants / Prevention of phagosomal-lysosomal fusion / IRAK2 mediated activation of TAK1 complex / Alpha-protein kinase 1 signaling pathway / Glycogen synthesis / Recognition and association of DNA glycosylase with site containing an affected pyrimidine / Cleavage of the damaged pyrimidine / IRAK1 recruits IKK complex / IRAK1 recruits IKK complex upon TLR7/8 or 9 stimulation / Membrane binding and targetting of GAG proteins / Endosomal Sorting Complex Required For Transport (ESCRT) / IRAK2 mediated activation of TAK1 complex upon TLR7/8 or 9 stimulation / PTK6 Regulates RTKs and Their Effectors AKT1 and DOK1 / Negative regulation of FLT3 / Constitutive Signaling by NOTCH1 HD Domain Mutants / Regulation of FZD by ubiquitination / TICAM1,TRAF6-dependent induction of TAK1 complex / NOTCH2 Activation and Transmission of Signal to the Nucleus / TICAM1-dependent activation of IRF3/IRF7 / Inhibition of DNA recombination at telomere / Meiotic synapsis / APC/C:Cdc20 mediated degradation of Cyclin B / p75NTR recruits signalling complexes / Downregulation of ERBB4 signaling / telomere organization / APC-Cdc20 mediated degradation of Nek2A / PINK1-PRKN Mediated Mitophagy / TRAF6-mediated induction of TAK1 complex within TLR4 complex / TRAF6 mediated IRF7 activation in TLR7/8 or 9 signaling / Pexophagy / Regulation of innate immune responses to cytosolic DNA / InlA-mediated entry of Listeria monocytogenes into host cells / VLDLR internalisation and degradation / RNA Polymerase I Promoter Opening / Downregulation of ERBB2:ERBB3 signaling / NF-kB is activated and signals survival / NRIF signals cell death from the nucleus / Regulation of PTEN localization / Assembly of the ORC complex at the origin of replication / Activated NOTCH1 Transmits Signal to the Nucleus / Regulation of BACH1 activity / Translesion synthesis by REV1 / Synthesis of active ubiquitin: roles of E1 and E2 enzymes / Translesion synthesis by POLK / MAP3K8 (TPL2)-dependent MAPK1/3 activation / TICAM1, RIP1-mediated IKK complex recruitment / Downregulation of TGF-beta receptor signaling / DNA methylation / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / Translesion synthesis by POLI / Gap-filling DNA repair synthesis and ligation in GG-NER / Josephin domain DUBs / neuron projection morphogenesis / Regulation of activated PAK-2p34 by proteasome mediated degradation / Condensation of Prophase Chromosomes / InlB-mediated entry of Listeria monocytogenes into host cell / IKK complex recruitment mediated by RIP1 / JNK (c-Jun kinases) phosphorylation and activation mediated by activated human TAK1 / ERCC6 (CSB) and EHMT2 (G9a) positively regulate rRNA expression / SIRT1 negatively regulates rRNA expression / Chromatin modifications during the maternal to zygotic transition (MZT) / HCMV Late Events / TGF-beta receptor signaling in EMT (epithelial to mesenchymal transition) / regulation of mitochondrial membrane potential / N-glycan trimming in the ER and Calnexin/Calreticulin cycle / PRC2 methylates histones and DNA / Autodegradation of Cdh1 by Cdh1:APC/C / innate immune response in mucosa / TNFR1-induced NF-kappa-B signaling pathway / DNA damage checkpoint signaling / APC/C:Cdc20 mediated degradation of Securin 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト)synthetic construct (人工物) | ||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.57 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Ai, H.S. / Liu, A.J. / Lou, Z.Y. / Liu, L. | ||||||||||||||||||
| 資金援助 |  中国, 5件 中国, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Chem Biol / 年: 2022 ジャーナル: Nat Chem Biol / 年: 2022タイトル: H2B Lys34 Ubiquitination Induces Nucleosome Distortion to Stimulate Dot1L Activity. 著者: Huasong Ai / Maoshen Sun / Aijun Liu / Zixian Sun / Tingting Liu / Lin Cao / Lujun Liang / Qian Qu / Zichen Li / Zhiheng Deng / Zebin Tong / Guochao Chu / Xiaolin Tian / Haiteng Deng / Suwen ...著者: Huasong Ai / Maoshen Sun / Aijun Liu / Zixian Sun / Tingting Liu / Lin Cao / Lujun Liang / Qian Qu / Zichen Li / Zhiheng Deng / Zebin Tong / Guochao Chu / Xiaolin Tian / Haiteng Deng / Suwen Zhao / Jia-Bin Li / Zhiyong Lou / Lei Liu /  要旨: Ubiquitination-dependent histone crosstalk plays critical roles in chromatin-associated processes and is highly associated with human diseases. Mechanism studies of the crosstalk have been of the ...Ubiquitination-dependent histone crosstalk plays critical roles in chromatin-associated processes and is highly associated with human diseases. Mechanism studies of the crosstalk have been of the central focus. Here our study on the crosstalk between H2BK34ub and Dot1L-catalyzed H3K79me suggests a novel mechanism of ubiquitination-induced nucleosome distortion to stimulate the activity of an enzyme. We determined the cryo-electron microscopy structures of Dot1L-H2BK34ub nucleosome complex and the H2BK34ub nucleosome alone. The structures reveal that H2BK34ub induces an almost identical orientation and binding pattern of Dot1L on nucleosome as H2BK120ub, which positions Dot1L for the productive conformation through direct ubiquitin-enzyme contacts. However, H2BK34-anchored ubiquitin does not directly interact with Dot1L as occurs in the case of H2BK120ub, but rather induces DNA and histone distortion around the modified site. Our findings establish the structural framework for understanding the H2BK34ub-H3K79me trans-crosstalk and highlight the diversity of mechanisms for histone ubiquitination to activate chromatin-modifying enzymes. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7xcr.cif.gz 7xcr.cif.gz | 395.8 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7xcr.ent.gz pdb7xcr.ent.gz | 304.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7xcr.json.gz 7xcr.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7xcr_validation.pdf.gz 7xcr_validation.pdf.gz | 1.1 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7xcr_full_validation.pdf.gz 7xcr_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  7xcr_validation.xml.gz 7xcr_validation.xml.gz | 44.2 KB | 表示 | |
| CIF形式データ |  7xcr_validation.cif.gz 7xcr_validation.cif.gz | 70.7 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/xc/7xcr https://data.pdbj.org/pub/pdb/validation_reports/xc/7xcr ftp://data.pdbj.org/pub/pdb/validation_reports/xc/7xcr ftp://data.pdbj.org/pub/pdb/validation_reports/xc/7xcr | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 6種, 10分子 LFBGCHDKEA
| #1: タンパク質 | 分子量: 8576.831 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: UBB / 発現宿主: Homo sapiens (ヒト) / 遺伝子: UBB / 発現宿主:  | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| #2: タンパク質 | 分子量: 10061.849 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 発現宿主: Homo sapiens (ヒト) / 発現宿主:  #3: タンパク質 | 分子量: 11865.871 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: HIST1H2AB, HIST1H2AE, hCG_1640984, hCG_1787383 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: HIST1H2AB, HIST1H2AE, hCG_1640984, hCG_1787383 / 発現宿主:  #4: タンパク質 | 分子量: 10477.994 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: H2BC12, H2BFT, HIRIP1, HIST1H2BK / 発現宿主: Homo sapiens (ヒト) / 遺伝子: H2BC12, H2BFT, HIRIP1, HIST1H2BK / 発現宿主:  #5: タンパク質 | | 分子量: 37930.039 Da / 分子数: 1 / 由来タイプ: 組換発現 / 詳細: SAM / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: DOT1L / 発現宿主: Homo sapiens (ヒト) / 遺伝子: DOT1L / 発現宿主:  #6: タンパク質 | 分子量: 11615.594 Da / 分子数: 2 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) / 参照: UniProt: S4RAZ3 |
-DNA鎖 , 2種, 2分子 IJ
| #7: DNA鎖 | 分子量: 44825.559 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
|---|---|
| #8: DNA鎖 | 分子量: 45305.852 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成) synthetic construct (人工物) |
-非ポリマー , 1種, 1分子 
| #9: 化合物 | ChemComp-SAM / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Complex of Dot1L(1-416) and H2BK34ub nucleosome / タイプ: COMPLEX / Entity ID: #1-#8 / 由来: RECOMBINANT |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 由来(組換発現) | 生物種:  |
| 緩衝液 | pH: 7.5 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: OTHER |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2500 nm / 最小 デフォーカス(公称値): 1000 nm |
| 撮影 | 平均露光時間: 2.56 sec. / 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.18.2_3874: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING ONLY | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 2.57 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 199459 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー









 PDBj
PDBj






















































