+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7rqu | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the full-length TRPV1 with RTx at 4 degrees Celsius, in a closed state, class I | ||||||
 要素 要素 | Transient receptor potential cation channel subfamily V member 1 | ||||||
 キーワード キーワード | MEMBRANE PROTEIN / ligand-gating ion channel | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報temperature-gated ion channel activity / response to capsazepine / negative regulation of establishment of blood-brain barrier / sensory perception of mechanical stimulus / peptide secretion / urinary bladder smooth muscle contraction / detection of chemical stimulus involved in sensory perception of pain / smooth muscle contraction involved in micturition / TRP channels / cellular response to temperature stimulus ...temperature-gated ion channel activity / response to capsazepine / negative regulation of establishment of blood-brain barrier / sensory perception of mechanical stimulus / peptide secretion / urinary bladder smooth muscle contraction / detection of chemical stimulus involved in sensory perception of pain / smooth muscle contraction involved in micturition / TRP channels / cellular response to temperature stimulus / cellular response to acidic pH / fever generation / detection of temperature stimulus involved in thermoception / thermoception / negative regulation of systemic arterial blood pressure / glutamate secretion / chloride channel regulator activity / response to pH / dendritic spine membrane / monoatomic cation transmembrane transporter activity / excitatory extracellular ligand-gated monoatomic ion channel activity / negative regulation of heart rate / cellular response to ATP / temperature homeostasis / response to pain / cellular response to alkaloid / calcium ion import across plasma membrane / behavioral response to pain / diet induced thermogenesis / cellular response to cytokine stimulus / detection of temperature stimulus involved in sensory perception of pain / intracellularly gated calcium channel activity / negative regulation of mitochondrial membrane potential / ligand-gated monoatomic ion channel activity / extracellular ligand-gated monoatomic ion channel activity / monoatomic cation channel activity / GABA-ergic synapse / sensory perception of pain / phosphatidylinositol binding / cellular response to nerve growth factor stimulus / phosphoprotein binding / calcium ion transmembrane transport / microglial cell activation / calcium channel activity / lipid metabolic process / cellular response to growth factor stimulus / response to peptide hormone / calcium ion transport / positive regulation of nitric oxide biosynthetic process / transmembrane signaling receptor activity / cellular response to tumor necrosis factor / cellular response to heat / positive regulation of cytosolic calcium ion concentration / response to heat / monoatomic ion transmembrane transport / postsynaptic membrane / protein homotetramerization / calmodulin binding / neuron projection / positive regulation of apoptotic process / external side of plasma membrane / neuronal cell body / dendrite / negative regulation of transcription by RNA polymerase II / ATP binding / identical protein binding / membrane / metal ion binding / plasma membrane 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.05 Å | ||||||
 データ登録者 データ登録者 | Kwon, D.H. / Suo, Y. / Lee, S.-Y. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Vanilloid-dependent TRPV1 opening trajectory from cryoEM ensemble analysis. 著者: Do Hoon Kwon / Feng Zhang / Justin G Fedor / Yang Suo / Seok-Yong Lee /  要旨: Single particle cryo-EM often yields multiple protein conformations within a single dataset, but experimentally deducing the temporal relationship of these conformers within a conformational ...Single particle cryo-EM often yields multiple protein conformations within a single dataset, but experimentally deducing the temporal relationship of these conformers within a conformational trajectory is not trivial. Here, we use thermal titration methods and cryo-EM in an attempt to obtain temporal resolution of the conformational trajectory of the vanilloid receptor TRPV1 with resiniferatoxin (RTx) bound. Based on our cryo-EM ensemble analysis, RTx binding to TRPV1 appears to induce intracellular gate opening first, followed by selectivity filter dilation, then pore loop rearrangement to reach the final open state. This apparent conformational wave likely arises from the concerted, stepwise, additive structural changes of TRPV1 over many subdomains. Greater understanding of the RTx-mediated long-range allostery of TRPV1 could help further the therapeutic potential of RTx, which is a promising drug candidate for pain relief associated with advanced cancer or knee arthritis. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7rqu.cif.gz 7rqu.cif.gz | 777.4 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7rqu.ent.gz pdb7rqu.ent.gz | 661.6 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7rqu.json.gz 7rqu.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7rqu_validation.pdf.gz 7rqu_validation.pdf.gz | 2.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7rqu_full_validation.pdf.gz 7rqu_full_validation.pdf.gz | 2.4 MB | 表示 | |
| XML形式データ |  7rqu_validation.xml.gz 7rqu_validation.xml.gz | 80 KB | 表示 | |
| CIF形式データ |  7rqu_validation.cif.gz 7rqu_validation.cif.gz | 107.6 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/rq/7rqu https://data.pdbj.org/pub/pdb/validation_reports/rq/7rqu ftp://data.pdbj.org/pub/pdb/validation_reports/rq/7rqu ftp://data.pdbj.org/pub/pdb/validation_reports/rq/7rqu | HTTPS FTP |
-関連構造データ
| 関連構造データ |  24636MC  7rqvC  7rqwC  7rqxC  7rqyC  7rqzC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 1種, 4分子 ACBD
| #1: タンパク質 | 分子量: 98719.758 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 参照: UniProt: O35433 Homo sapiens (ヒト) / 参照: UniProt: O35433 |
|---|
-非ポリマー , 5種, 38分子 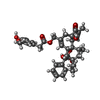

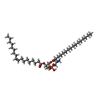
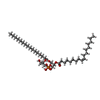





| #2: 化合物 | ChemComp-6EU / #3: 化合物 | ChemComp-LBN / #4: 化合物 | ChemComp-6OU / [( #5: 化合物 | ChemComp-YFP / #6: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Transient receptor potential cation channel subfamily V member 1 タイプ: COMPLEX / Entity ID: #1 / 由来: RECOMBINANT | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.4 MDa / 実験値: NO | ||||||||||||
| 由来(天然) | 生物種:  | ||||||||||||
| 由来(組換発現) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 緩衝液 | pH: 7.5 | ||||||||||||
| 緩衝液成分 |
| ||||||||||||
| 試料 | 濃度: 0.9 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | ||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのタイプ: UltrAuFoil R1.2/1.3 | ||||||||||||
| 急速凍結 | 装置: LEICA EM GP / 凍結剤: ETHANE / 湿度: 90 % / 凍結前の試料温度: 277 K |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 81000 X / 最大 デフォーカス(公称値): 1800 nm / 最小 デフォーカス(公称値): 800 nm / Cs: 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 撮影 | 平均露光時間: 4 sec. / 電子線照射量: 60 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 2427 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 20 eV |
| 画像スキャン | 横: 5760 / 縦: 4092 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2700 | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C4 (4回回転対称) | ||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.05 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 81347 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | B value: 132 / プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | PDB-ID: 7LP9 PDB chain-ID: A |
 ムービー
ムービー コントローラー
コントローラー








 PDBj
PDBj







