+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Kalium channelrhodopsin 1 C110A mutant from Hyphochytrium catenoides, Dark State | |||||||||||||||
 マップデータ マップデータ | Kalium channelrhodopsin 1 C110A mutant from Hyphochytrium catenoides, Dark State | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Retinal Protein / Channelrhodopsin / Cation Channel / Peptidisc / Optogenetics / Transport Protein / MEMBRANE PROTEIN | |||||||||||||||
| 生物種 |  Hyphochytrium catenoides (真核生物) Hyphochytrium catenoides (真核生物) | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.08 Å | |||||||||||||||
 データ登録者 データ登録者 | Morizumi T / Kim K / Ernst OP | |||||||||||||||
| 資金援助 |  米国, 米国,  カナダ, 4件 カナダ, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2025 ジャーナル: Nat Commun / 年: 2025タイトル: Structural insights into light-gating of potassium-selective channelrhodopsin. 著者: Takefumi Morizumi / Kyumhyuk Kim / Hai Li / Probal Nag / Tal Dogon / Oleg A Sineshchekov / Yumei Wang / Leonid S Brown / Songhwan Hwang / Han Sun / Ana-Nicoleta Bondar / Igor Schapiro / Elena ...著者: Takefumi Morizumi / Kyumhyuk Kim / Hai Li / Probal Nag / Tal Dogon / Oleg A Sineshchekov / Yumei Wang / Leonid S Brown / Songhwan Hwang / Han Sun / Ana-Nicoleta Bondar / Igor Schapiro / Elena G Govorunova / John L Spudich / Oliver P Ernst /      要旨: Structural information on channelrhodopsins' mechanism of light-gated ion conductance is scarce, limiting its engineering as optogenetic tools. Here, we use single-particle cryo-electron microscopy ...Structural information on channelrhodopsins' mechanism of light-gated ion conductance is scarce, limiting its engineering as optogenetic tools. Here, we use single-particle cryo-electron microscopy of peptidisc-incorporated protein samples to determine the structures of the slow-cycling mutant C110A of kalium channelrhodopsin 1 from Hyphochytrium catenoides (HcKCR1) in the dark and upon laser flash excitation. Upon photoisomerization of the retinal chromophore, the retinylidene Schiff base NH-bond reorients from the extracellular to the cytoplasmic side. This switch triggers a series of side chain reorientations and merges intramolecular cavities into a transmembrane K conduction pathway. Molecular dynamics simulations confirm K flux through the illuminated state but not through the resting state. The overall displacement between the closed and the open structure is small, involving mainly side chain rearrangements. Asp105 and Asp116 play a key role in K conductance. Structure-guided mutagenesis and patch-clamp analysis reveal the roles of the pathway-forming residues in channel gating and selectivity. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_45467.map.gz emd_45467.map.gz | 59.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-45467-v30.xml emd-45467-v30.xml emd-45467.xml emd-45467.xml | 20.8 KB 20.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_45467_fsc.xml emd_45467_fsc.xml | 8.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_45467.png emd_45467.png | 54.2 KB | ||
| Filedesc metadata |  emd-45467.cif.gz emd-45467.cif.gz | 6.7 KB | ||
| その他 |  emd_45467_half_map_1.map.gz emd_45467_half_map_1.map.gz emd_45467_half_map_2.map.gz emd_45467_half_map_2.map.gz | 59.4 MB 59.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-45467 http://ftp.pdbj.org/pub/emdb/structures/EMD-45467 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45467 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-45467 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_45467_validation.pdf.gz emd_45467_validation.pdf.gz | 906.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_45467_full_validation.pdf.gz emd_45467_full_validation.pdf.gz | 906.2 KB | 表示 | |
| XML形式データ |  emd_45467_validation.xml.gz emd_45467_validation.xml.gz | 16.1 KB | 表示 | |
| CIF形式データ |  emd_45467_validation.cif.gz emd_45467_validation.cif.gz | 20.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45467 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45467 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45467 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-45467 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_45467.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_45467.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Kalium channelrhodopsin 1 C110A mutant from Hyphochytrium catenoides, Dark State | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.03 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half Map B
| ファイル | emd_45467_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half Map A
| ファイル | emd_45467_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Kalium Channelrhodopin 1 C110A Reconstituted in Peptidisc, Dark State
| 全体 | 名称: Kalium Channelrhodopin 1 C110A Reconstituted in Peptidisc, Dark State |
|---|---|
| 要素 |
|
-超分子 #1: Kalium Channelrhodopin 1 C110A Reconstituted in Peptidisc, Dark State
| 超分子 | 名称: Kalium Channelrhodopin 1 C110A Reconstituted in Peptidisc, Dark State タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Hyphochytrium catenoides (真核生物) Hyphochytrium catenoides (真核生物) |
| 分子量 | 理論値: 91.385 MDa |
-分子 #1: Kalium channelrhodopsin 1 C110A
| 分子 | 名称: Kalium channelrhodopsin 1 C110A / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Hyphochytrium catenoides (真核生物) Hyphochytrium catenoides (真核生物) |
| 分子量 | 理論値: 30.483678 KDa |
| 組換発現 | 生物種:  Komagataella pastoris (菌類) Komagataella pastoris (菌類) |
| 配列 | 文字列: MPFYDSRPPE GWPKGSINDM DYPLLGSICA VCCVFVAGSG IWMLYRLDLG MGYSCKPYKS GRAPEVNSLS GIICLLCGTM YAAKSFDFF DGGGTPFSLN WYWYLDYVFT APLLILDFAF TLDLPHKIRY FFAVFLTLWC GVAAFVTPSA YRFAYYALGC C WFTPFALS ...文字列: MPFYDSRPPE GWPKGSINDM DYPLLGSICA VCCVFVAGSG IWMLYRLDLG MGYSCKPYKS GRAPEVNSLS GIICLLCGTM YAAKSFDFF DGGGTPFSLN WYWYLDYVFT APLLILDFAF TLDLPHKIRY FFAVFLTLWC GVAAFVTPSA YRFAYYALGC C WFTPFALS LMRHVKERYL VYPPKCQRWL FWACVIFFGF WPMFPILFIF SWLGTGHISQ QAFYIIHAFL DLTCKSIFGI LM TVFRLEL EEHTEVQGLP LNEPETLS |
-分子 #2: RETINAL
| 分子 | 名称: RETINAL / タイプ: ligand / ID: 2 / コピー数: 1 / 式: RET |
|---|---|
| 分子量 | 理論値: 284.436 Da |
| Chemical component information | 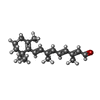 ChemComp-RET: |
-分子 #3: CHOLESTEROL
| 分子 | 名称: CHOLESTEROL / タイプ: ligand / ID: 3 / コピー数: 3 / 式: CLR |
|---|---|
| 分子量 | 理論値: 386.654 Da |
| Chemical component information |  ChemComp-CLR: |
-分子 #4: 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine
| 分子 | 名称: 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine / タイプ: ligand / ID: 4 / コピー数: 4 / 式: PEE |
|---|---|
| 分子量 | 理論値: 744.034 Da |
| Chemical component information | 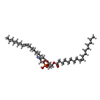 ChemComp-PEE: |
-分子 #5: water
| 分子 | 名称: water / タイプ: ligand / ID: 5 / コピー数: 20 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||
| グリッド | モデル: Homemade / 材質: COPPER/RHODIUM / メッシュ: 400 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 35 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 0.038 kPa | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 278 K / 装置: FEI VITROBOT MARK IV | |||||||||
| 詳細 | Sample was monodisperse |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: TFS FALCON 4i (4k x 4k) 撮影したグリッド数: 1 / 実像数: 5483 / 平均露光時間: 7.5 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 75000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)






































