+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Straight actin filament from Arp2/3 branch junction sample (ADP) | ||||||||||||
 マップデータ マップデータ | Helical F-actin from Arp2/3 branch complex (ADP) | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | actin / arp2/3 / cytoskeleton / branch / CYTOSOLIC PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoskeletal motor activator activity / tropomyosin binding / mesenchyme migration / troponin I binding / myosin heavy chain binding / filamentous actin / actin filament bundle / skeletal muscle thin filament assembly / striated muscle thin filament / actin filament bundle assembly ...cytoskeletal motor activator activity / tropomyosin binding / mesenchyme migration / troponin I binding / myosin heavy chain binding / filamentous actin / actin filament bundle / skeletal muscle thin filament assembly / striated muscle thin filament / actin filament bundle assembly / skeletal muscle myofibril / actin monomer binding / skeletal muscle fiber development / stress fiber / titin binding / actin filament polymerization / filopodium / actin filament / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding / lamellipodium / cell body / hydrolase activity / protein domain specific binding / calcium ion binding / positive regulation of gene expression / magnesium ion binding / ATP binding / identical protein binding / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |   | ||||||||||||
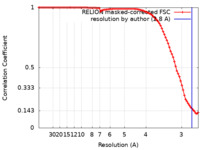
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 2.8 Å | ||||||||||||
 データ登録者 データ登録者 | Chavali SS / Chou SZ / Sindelar CV | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2024 ジャーナル: Nat Commun / 年: 2024タイトル: Cryo-EM structures reveal how phosphate release from Arp3 weakens actin filament branches formed by Arp2/3 complex. 著者: Sai Shashank Chavali / Steven Z Chou / Wenxiang Cao / Thomas D Pollard / Enrique M De La Cruz / Charles V Sindelar /  要旨: Arp2/3 complex nucleates branched actin filaments for cell and organelle movements. Here we report a 2.7 Å resolution cryo-EM structure of the mature branch junction formed by S. pombe Arp2/3 ...Arp2/3 complex nucleates branched actin filaments for cell and organelle movements. Here we report a 2.7 Å resolution cryo-EM structure of the mature branch junction formed by S. pombe Arp2/3 complex that provides details about interactions with both mother and daughter filaments. We determine a second structure at 3.2 Å resolution with the phosphate analog BeF bound with ADP to Arp3 and ATP bound to Arp2. In this ADP-BeF transition state the outer domain of Arp3 is rotated 2° toward the mother filament compared with the ADP state and makes slightly broader contacts with actin in both the mother and daughter filaments. Thus, dissociation of P from the ADP-P transition state reduces the interactions of Arp2/3 complex with the actin filaments and may contribute to the lower mechanical stability of mature branch junctions with ADP bound to the Arps. Our structures also reveal that the mother filament in contact with Arp2/3 complex is slightly bent and twisted, consistent with the preference of Arp2/3 complex binding curved actin filaments. The small degree of twisting constrains models of actin filament mechanics. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42829.map.gz emd_42829.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42829-v30.xml emd-42829-v30.xml emd-42829.xml emd-42829.xml | 19.7 KB 19.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_42829_fsc.xml emd_42829_fsc.xml | 9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_42829.png emd_42829.png | 77.4 KB | ||
| Filedesc metadata |  emd-42829.cif.gz emd-42829.cif.gz | 6.7 KB | ||
| その他 |  emd_42829_half_map_1.map.gz emd_42829_half_map_1.map.gz emd_42829_half_map_2.map.gz emd_42829_half_map_2.map.gz | 59.4 MB 59.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42829 http://ftp.pdbj.org/pub/emdb/structures/EMD-42829 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42829 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42829 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42829_validation.pdf.gz emd_42829_validation.pdf.gz | 983.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42829_full_validation.pdf.gz emd_42829_full_validation.pdf.gz | 983.2 KB | 表示 | |
| XML形式データ |  emd_42829_validation.xml.gz emd_42829_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  emd_42829_validation.cif.gz emd_42829_validation.cif.gz | 21.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42829 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42829 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42829 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42829 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42829.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42829.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Helical F-actin from Arp2/3 branch complex (ADP) | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.346 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Helical F-actin from Arp2/3 branch complex (ADP)
| ファイル | emd_42829_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Helical F-actin from Arp2/3 branch complex (ADP) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Helical F-actin from Arp2/3 branch complex (ADP)
| ファイル | emd_42829_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Helical F-actin from Arp2/3 branch complex (ADP) | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Actin
| 全体 | 名称: Actin |
|---|---|
| 要素 |
|
-超分子 #1: Actin
| 超分子 | 名称: Actin / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: Actin filament |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Actin, alpha skeletal muscle
| 分子 | 名称: Actin, alpha skeletal muscle / タイプ: protein_or_peptide / ID: 1 / コピー数: 9 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 41.51634 KDa |
| 配列 | 文字列: ETTALVCDNG SGLVKAGFAG DDAPRAVFPS IVGRPRHQGV MVGMGQKDSY VGDEAQSKRG ILTLKYPIE(HIC) GIITNW DDM EKIWHHTFYN ELRVAPEEHP TLLTEAPLNP KANREKMTQI MFETFNVPAM YVAIQAVLSL YASGRTTGIV LDSGDGV TH ...文字列: ETTALVCDNG SGLVKAGFAG DDAPRAVFPS IVGRPRHQGV MVGMGQKDSY VGDEAQSKRG ILTLKYPIE(HIC) GIITNW DDM EKIWHHTFYN ELRVAPEEHP TLLTEAPLNP KANREKMTQI MFETFNVPAM YVAIQAVLSL YASGRTTGIV LDSGDGV TH NVPIYEGYAL PHAIMRLDLA GRDLTDYLMK ILTERGYSFV TTAEREIVRD IKEKLCYVAL DFENEMATAA SSSSLEKS Y ELPDGQVITI GNERFRCPET LFQPSFIGME SAGIHETTYN SIMKCDIDIR KDLYANNVMS GGTTMYPGIA DRMQKEITA LAPSTMKIKI IAPPERKYSV WIGGSILASL STFQQMWITK QEYDEAGPSI VHRKCF UniProtKB: Actin, alpha skeletal muscle |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 9 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 9 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: The samples were incubated on the grid for 50 s and the extra solution was blotted using two Vitrobot filter papers (0.55/20 mm, Grade 595, Ted Pella) for 4 s at 0 blot force. The grids were ...詳細: The samples were incubated on the grid for 50 s and the extra solution was blotted using two Vitrobot filter papers (0.55/20 mm, Grade 595, Ted Pella) for 4 s at 0 blot force. The grids were plunged into liquid ethane at ~180 degrees C with a wait time of 0.5 s.. |
| 詳細 | Actin monomers with bound Ca2+ were converted to Mg2+-actin by equilibrating with 50 micromolar MgCl2 and 0.2 mM EGTA (pH 7.5) for 10 min on ice. Actin was polymerized in the presence of capping protein (CP) by sequentially mixing 8.75 micromolar Mg-ATP-actin monomers with 0.75 micromolar CP and equilibrated at room temperature for 1 h. In parallel, Arp2/3 complex (0.4 micromolar) in QB buffer was activated by mixing 0.85 micromolar GCN4-VCA and 50 micromolar ATP and incubated at 4 degrees for 1 h. The capped actin filaments sample was then gently mixed with an equal volume of activated Arp2/3 complex sample using cut pipette tips and equilibrated at 4 degrees for 5 min. Daughter filaments were formed and elongated in the presence of CP by adding 0.25 micromolar Mg-actin monomers, 50 micromolar ATP, and 40 nM CP and incubated for 5 min at room temperature. This step was subsequently repeated 4 more times, then aged for ~90 min before preparing grids for cryo-EM data collection. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV 詳細: Electron micrographs for image reconstructions were collected using Titan Krios equipped with X-cold field emission gun at 300 kV, Gatan image filter with slit width of 20 eV and a nanoprobe. |
| 詳細 | The vitrified grids were screened for sample homogeneity and ice thickness in a Glacios 200 kV transmission electron microscope equipped with Gatan K2 summit camera. Electron micrographs for image reconstructions were collected using Titan Krios equipped with X-cold field emission gun at 300 kV, Gatan image filter with slit width of 20 eV and a nanoprobe. |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 8519 / 平均露光時間: 3.3 sec. / 平均電子線量: 51.4 e/Å2 詳細: Each movie contains 41 frames with a frame time of 0.08 s. A dose rate of 28.4 counts/pixel/s and a physical pixel size of 1.346 Angstroms was used. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 64000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X