+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
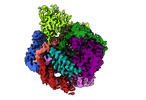
| タイトル | Human LINE-1 retrotransposon ORF2 protein engaged with template RNA in elongation state | |||||||||
 マップデータ マップデータ | Human LINE-1 retrotransposon ORF2 protein engaged with template RNA in elongation state | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | LINE-1 / retrotransposon / reverse transcriptase / retroelement / RNA BINDING PROTEIN / RNA / RNA BINDING PROTEIN-RNA-DNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報retrotransposition / nucleic acid metabolic process / type II site-specific deoxyribonuclease activity / 加水分解酵素; エステル加水分解酵素; 5'-リン酸モノエステル産生エンドデオキシリボヌクレアーゼ / RNA-directed DNA polymerase / RNA-directed DNA polymerase activity / DNA recombination / RNA binding / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
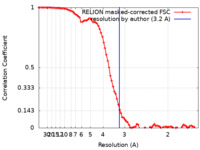
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Thawani A / Florez Ariza AJ / Collins K / Nogales E | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Template and target-site recognition by human LINE-1 in retrotransposition. 著者: Akanksha Thawani / Alfredo Jose Florez Ariza / Eva Nogales / Kathleen Collins /  要旨: The long interspersed element-1 (LINE-1, hereafter L1) retrotransposon has generated nearly one-third of the human genome and serves as an active source of genetic diversity and human disease. L1 ...The long interspersed element-1 (LINE-1, hereafter L1) retrotransposon has generated nearly one-third of the human genome and serves as an active source of genetic diversity and human disease. L1 spreads through a mechanism termed target-primed reverse transcription, in which the encoded enzyme (ORF2p) nicks the target DNA to prime reverse transcription of its own or non-self RNAs. Here we purified full-length L1 ORF2p and biochemically reconstituted robust target-primed reverse transcription with template RNA and target-site DNA. We report cryo-electron microscopy structures of the complete human L1 ORF2p bound to structured template RNAs and initiating cDNA synthesis. The template polyadenosine tract is recognized in a sequence-specific manner by five distinct domains. Among them, an RNA-binding domain bends the template backbone to allow engagement of an RNA hairpin stem with the L1 ORF2p C-terminal segment. Moreover, structure and biochemical reconstitutions demonstrate an unexpected target-site requirement: L1 ORF2p relies on upstream single-stranded DNA to position the adjacent duplex in the endonuclease active site for nicking of the longer DNA strand, with a single nick generating a staggered DNA break. Our research provides insights into the mechanism of ongoing transposition in the human genome and informs the engineering of retrotransposon proteins for gene therapy. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_42637.map.gz emd_42637.map.gz | 5.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-42637-v30.xml emd-42637-v30.xml emd-42637.xml emd-42637.xml | 18 KB 18 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_42637_fsc.xml emd_42637_fsc.xml | 8.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_42637.png emd_42637.png | 81.7 KB | ||
| Filedesc metadata |  emd-42637.cif.gz emd-42637.cif.gz | 6.9 KB | ||
| その他 |  emd_42637_half_map_1.map.gz emd_42637_half_map_1.map.gz emd_42637_half_map_2.map.gz emd_42637_half_map_2.map.gz | 40.8 MB 40.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-42637 http://ftp.pdbj.org/pub/emdb/structures/EMD-42637 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42637 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-42637 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_42637_validation.pdf.gz emd_42637_validation.pdf.gz | 775.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_42637_full_validation.pdf.gz emd_42637_full_validation.pdf.gz | 774.7 KB | 表示 | |
| XML形式データ |  emd_42637_validation.xml.gz emd_42637_validation.xml.gz | 14.2 KB | 表示 | |
| CIF形式データ |  emd_42637_validation.cif.gz emd_42637_validation.cif.gz | 20.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42637 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42637 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42637 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-42637 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8uw3MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_42637.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_42637.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human LINE-1 retrotransposon ORF2 protein engaged with template RNA in elongation state | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.81 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half Map 2
| ファイル | emd_42637_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half Map 1
| ファイル | emd_42637_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human LINE-1 retrotransposon ORF2 protein in elongation stage
| 全体 | 名称: Human LINE-1 retrotransposon ORF2 protein in elongation stage |
|---|---|
| 要素 |
|
-超分子 #1: Human LINE-1 retrotransposon ORF2 protein in elongation stage
| 超分子 | 名称: Human LINE-1 retrotransposon ORF2 protein in elongation stage タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 175 KDa |
-分子 #1: LINE-1 retrotransposable element ORF2 protein
| 分子 | 名称: LINE-1 retrotransposable element ORF2 protein / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 149.300391 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTGSNSHITI LTLNINGLNS AIKRHRLASW IKSQDPSVCC IQETHLTCRD THRLKIKGWR KIYQANGKQK KAGVAILVSD KTDFKPTKI KRDKEGHYIM VKGSIQQEEL TILNIYAPNT GAPRFIKQVL SDLQRDLDSH TLIMGDFNTP LSTLDRSTRQ K VNKDTQEL ...文字列: MTGSNSHITI LTLNINGLNS AIKRHRLASW IKSQDPSVCC IQETHLTCRD THRLKIKGWR KIYQANGKQK KAGVAILVSD KTDFKPTKI KRDKEGHYIM VKGSIQQEEL TILNIYAPNT GAPRFIKQVL SDLQRDLDSH TLIMGDFNTP LSTLDRSTRQ K VNKDTQEL NSALHQADLI DIYRTLHPKS TEYTFFSAPH HTYSKIDHIV GSKALLSKCK RTEIITNYLS DHSAIKLELR IK NLTQSRS TTWKLNNLLL NDYWVHNEMK AEIKMFFETN ENKDTTYQNL WDAFKAVCRG KFIALNAHKR KQERSKIDTL TSQ LKELEK QEQTHSKASR RQEITKIRAE LKEIETQKTL QKINESRSWF FERINKIDRP LARLIKKKRE KNQIDTIKND KGDI TTDPT EIQTTIREYY KHLYANKLEN LEEMDKFLDT YTLPRLNQEE VESLNRPITG SEIVAIINSL PTKKSPGPDG FTAEF YQRY KEELVPFLLK LFQSIEKEGI LPNSFYEASI ILIPKPGRDT TKKENFRPIS LMNIDAKILN KILANRIQQH IKKLIH HDQ VGFIPGMQGW FNIRKSINVI QHINRAKDKN HMIISIDAEK AFDKIQQPFM LKTLNKLGID GTYFKIIRAI YDKPTAN II LNGQKLEAFP LKTGTRQGCP LSPLLFNIVL EVLARAIRQE KEIKGIQLGK EEVKLSLFAD DMIVYLENPI VSAQNLLK L ISNFSKVSGY KINVQKSQAF LYTNNRQTES QIMGELPFTI ASKRIKYLGI QLTRDVKDLF KENYKPLLKE IKEETNKWK NIPCSWVGRI NIVKMAILPK VIYRFNAIPI KLPMTFFTEL EKTTLKFIWN QKRARIAKSI LSQKNKAGGI TLPDFKLYYK ATVTKTAWY WYQNRDIDQW NRTEPSEIMP HIYNYLIFDK PEKNKQWGKD SLFNKWCWEN WLAICRKLKL DPFLTPYTKI N SRWIKDLN VKPKTIKTLE ENLGITIQDI GVGKDFMSKT PKAMATKDKI DKWDLIKLKS FCTAKETTIR VNRQPTTWEK IF ATYSSDK GLISRIYNEL KQIYKKKTNN PIKKWAKDMN RHFSKEDIYA AKKHMKKCSS SLAIREMQIK TTMRYHLTPV RMA IIKKSG NNRCWRGCGE IGTLLHCWWD CKLVQPLWKS VWRFLRDLEL EIPFDPAIPL LGIYPNEYKS CCYKDTCTRM FIAA LFTIA KTWNQPKCPT MIDWIKKMWH IYTMEYYAAI KNDEFISFVG TWMKLETIIL SKLSQEQKTK HRIFSLIGGN UniProtKB: LINE-1 retrotransposable element ORF2 protein |
-分子 #2: Template RNA
| 分子 | 名称: Template RNA / タイプ: rna / ID: 2 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 23.956451 KDa |
| 配列 | 文字列: GCAGACUGCG UAGGCGUGCA GGAACCUGCA CGCCUACGCA GUCUGCAAAA AAAAAAAAAA ACAAUAUCGG CGCG |
-分子 #3: Complementary DNA
| 分子 | 名称: Complementary DNA / タイプ: dna / ID: 3 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 3.951586 KDa |
| 配列 | 文字列: (DC)(DG)(DC)(DG)(DC)(DC)(DG)(DA)(DT)(DA) (DT)(DT)(DDG) |
-分子 #4: THYMIDINE-5'-TRIPHOSPHATE
| 分子 | 名称: THYMIDINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 1 / 式: TTP |
|---|---|
| 分子量 | 理論値: 482.168 Da |
| Chemical component information |  ChemComp-TTP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 11520 pixel / デジタル化 - サイズ - 縦: 8184 pixel / 撮影したグリッド数: 2 / 実像数: 23878 / 平均露光時間: 1.0 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 Z
Z Y
Y X
X