+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Myxococcus xanthus EncA protein shell with compartmentalized SNAP-tag cargo protein | |||||||||
 マップデータ マップデータ | Myxococcus xanthus EncA protein shell with compartmentalized SNAP-tag cargo protein | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Encapsulin / nanocompartment / VIRUS LIKE PARTICLE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報methylated-DNA-[protein]-cysteine S-methyltransferase / methylated-DNA-[protein]-cysteine S-methyltransferase activity / encapsulin nanocompartment / DNA modification / iron ion transport / methylation / intracellular iron ion homeostasis / DNA repair / DNA binding / nucleus / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Myxococcus xanthus DK 1622 (バクテリア) / Myxococcus xanthus DK 1622 (バクテリア) /  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
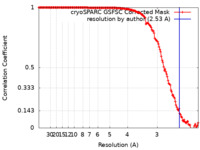
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.53 Å | |||||||||
 データ登録者 データ登録者 | Andreas MP / Kwon S / Giessen TW | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Struct Biol / 年: 2023 ジャーナル: J Struct Biol / 年: 2023タイトル: Structure and heterogeneity of a highly cargo-loaded encapsulin shell. 著者: Seokmu Kwon / Michael P Andreas / Tobias W Giessen /  要旨: Encapsulins are self-assembling protein nanocompartments able to selectively encapsulate dedicated cargo enzymes. Encapsulins are widespread across bacterial and archaeal phyla and are involved in ...Encapsulins are self-assembling protein nanocompartments able to selectively encapsulate dedicated cargo enzymes. Encapsulins are widespread across bacterial and archaeal phyla and are involved in oxidative stress resistance, iron storage, and sulfur metabolism. Encapsulin shells exhibit icosahedral geometry and consist of 60, 180, or 240 identical protein subunits. Cargo encapsulation is mediated by the specific interaction of targeting peptides or domains, found in all cargo proteins, with the interior surface of the encapsulin shell during shell self-assembly. Here, we report the 2.53 Å cryo-EM structure of a heterologously produced and highly cargo-loaded T3 encapsulin shell from Myxococcus xanthus and explore the systems' structural heterogeneity. We find that exceedingly high cargo loading results in the formation of substantial amounts of distorted and aberrant shells, likely caused by a combination of unfavorable steric clashes of cargo proteins and shell conformational changes. Based on our cryo-EM structure, we determine and analyze the targeting peptide-shell binding mode. We find that both ionic and hydrophobic interactions mediate targeting peptide binding. Our results will guide future attempts at rationally engineering encapsulins for biomedical and biotechnological applications. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41322.map.gz emd_41322.map.gz | 307.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41322-v30.xml emd-41322-v30.xml emd-41322.xml emd-41322.xml | 20.7 KB 20.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_41322_fsc.xml emd_41322_fsc.xml | 14.4 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_41322.png emd_41322.png | 184.9 KB | ||
| その他 |  emd_41322_half_map_1.map.gz emd_41322_half_map_1.map.gz emd_41322_half_map_2.map.gz emd_41322_half_map_2.map.gz | 301.2 MB 301.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41322 http://ftp.pdbj.org/pub/emdb/structures/EMD-41322 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41322 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41322 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_41322_validation.pdf.gz emd_41322_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_41322_full_validation.pdf.gz emd_41322_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_41322_validation.xml.gz emd_41322_validation.xml.gz | 23.5 KB | 表示 | |
| CIF形式データ |  emd_41322_validation.cif.gz emd_41322_validation.cif.gz | 30.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41322 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41322 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41322 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41322 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8tk7MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41322.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41322.map.gz / 形式: CCP4 / 大きさ: 325 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Myxococcus xanthus EncA protein shell with compartmentalized SNAP-tag cargo protein | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.10345 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half Map 1
| ファイル | emd_41322_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 1 | ||||||||||||
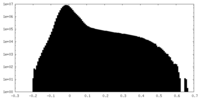
| 投影像・断面図 |
| ||||||||||||
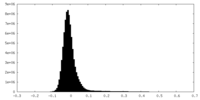
| 密度ヒストグラム |
-ハーフマップ: Half Map 2
| ファイル | emd_41322_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half Map 2 | ||||||||||||
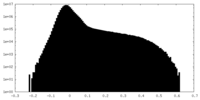
| 投影像・断面図 |
| ||||||||||||
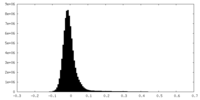
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Myxococcus xanthus EncA protein shell with compartmentalized SNAP...
| 全体 | 名称: Myxococcus xanthus EncA protein shell with compartmentalized SNAP-tag cargo protein |
|---|---|
| 要素 |
|
-超分子 #1: Myxococcus xanthus EncA protein shell with compartmentalized SNAP...
| 超分子 | 名称: Myxococcus xanthus EncA protein shell with compartmentalized SNAP-tag cargo protein タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Myxococcus xanthus DK 1622 (バクテリア) Myxococcus xanthus DK 1622 (バクテリア) |
-超分子 #2: Myxococcus xanthus EncA encapsulin shell protein
| 超分子 | 名称: Myxococcus xanthus EncA encapsulin shell protein / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 詳細: Recombinantly expressed Myxococcus xanthus EncA encapsulin shell with T=3 icosahedral symmetry |
|---|---|
| 由来(天然) | 生物種:  Myxococcus xanthus DK 1622 (バクテリア) Myxococcus xanthus DK 1622 (バクテリア) |
-超分子 #3: SNAP-Tag/EncC targeting peptide
| 超分子 | 名称: SNAP-Tag/EncC targeting peptide / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 詳細: Internalized SNAP-tag/EncC targeting peptide cargo protein |
|---|---|
| 由来(天然) | 生物種:  Myxococcus xanthus DK 1622 (バクテリア) Myxococcus xanthus DK 1622 (バクテリア) |
-分子 #1: Type 1 encapsulin shell protein EncA
| 分子 | 名称: Type 1 encapsulin shell protein EncA / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Myxococcus xanthus DK 1622 (バクテリア) Myxococcus xanthus DK 1622 (バクテリア) |
| 分子量 | 理論値: 31.691977 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPDFLGHAEN PLREEEWARL NETVIQVARR SLVGRRILDI YGPLGAGVQT VPYDEFQGVS PGAVDIVGEQ ETAMVFTDAR KFKTIPIIY KDFLLHWRDI EAARTHNMPL DVSAAAGAAA LCAQQEDELI FYGDARLGYE GLMTANGRLT VPLGDWTSPG G GFQAIVEA ...文字列: MPDFLGHAEN PLREEEWARL NETVIQVARR SLVGRRILDI YGPLGAGVQT VPYDEFQGVS PGAVDIVGEQ ETAMVFTDAR KFKTIPIIY KDFLLHWRDI EAARTHNMPL DVSAAAGAAA LCAQQEDELI FYGDARLGYE GLMTANGRLT VPLGDWTSPG G GFQAIVEA TRKLNEQGHF GPYAVVLSPR LYSQLHRIYE KTGVLEIETI RQLASDGVYQ SNRLRGESGV VVSTGRENMD LA VSMDMVA AYLGASRMNH PFRVLEALLL RIKHPDAICT LEGAGATERR UniProtKB: Type 1 encapsulin shell protein EncA |
-分子 #2: Methylated-DNA--protein-cysteine methyltransferase
| 分子 | 名称: Methylated-DNA--protein-cysteine methyltransferase / タイプ: protein_or_peptide / ID: 2 詳細: Amino acids 1-183 are unresolved SNAP-TAG. Amino acids 184-191 are unresolved linker. Amino acids 192-203 are EncC targeting peptide. コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 21.4826 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGPGSDKDCE MKRTTLDSPL GKLELSGCEQ GLHEIIFLGK GTSAADAVEV PAPAAVLGGP EPLMQATAWL NAYFHQPEAI EEFPVPALH HPVFQQESFT RQVLWKLLKV VKFGEVISYS HLAALAGNPA ATAAVKTALS GNPVPILIPC HRVVQGDLDV G GYEGGLAV ...文字列: MGPGSDKDCE MKRTTLDSPL GKLELSGCEQ GLHEIIFLGK GTSAADAVEV PAPAAVLGGP EPLMQATAWL NAYFHQPEAI EEFPVPALH HPVFQQESFT RQVLWKLLKV VKFGEVISYS HLAALAGNPA ATAAVKTALS GNPVPILIPC HRVVQGDLDV G GYEGGLAV KEWLLAHEGH RLGKRGGGSG GGSPEKRLTV GSLRR UniProtKB: Methylated-DNA--protein-cysteine methyltransferase |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3.4 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: 150 mM NaCl, 20 mM Tris pH 7.5 | |||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 4092 pixel / デジタル化 - サイズ - 縦: 5760 pixel / 撮影したグリッド数: 1 / 実像数: 2610 / 平均露光時間: 3.2 sec. / 平均電子線量: 49.26 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - Source name: PDB / Chain - Initial model type: experimental model |
|---|---|
| 詳細 | The model was initially fit into the map using UCSF ChimeraX. It was then manually refined using Coot, followed by real-space refinement against the map using Phenix. |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT / 温度因子: 89.9 当てはまり具合の基準: Cross-correlation coefficient |
| 得られたモデル |  PDB-8tk7: |
 ムービー
ムービー コントローラー
コントローラー





 Z
Z Y
Y X
X