+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
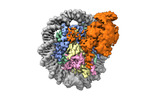
| タイトル | Catalytic and non-catalytic mechanisms of histone H4 lysine 20 methyltransferase SUV420H1 | |||||||||||||||
 マップデータ マップデータ | 3D reconstruction SUV420H1-H2A.Z nucleosome complex | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Chromatin / Histone H4 modification / Methyltransferase / GENE REGULATION | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報histone H4K20me methyltransferase activity / [histone H4]-N-methyl-L-lysine20 N-methyltransferase / histone H4K20 monomethyltransferase activity / [histone H4]-lysine20 N-methyltransferase / histone H4K20 methyltransferase activity / histone H4 methyltransferase activity / positive regulation of isotype switching / condensed chromosome, centromeric region / S-adenosyl-L-methionine binding / nucleosomal DNA binding ...histone H4K20me methyltransferase activity / [histone H4]-N-methyl-L-lysine20 N-methyltransferase / histone H4K20 monomethyltransferase activity / [histone H4]-lysine20 N-methyltransferase / histone H4K20 methyltransferase activity / histone H4 methyltransferase activity / positive regulation of isotype switching / condensed chromosome, centromeric region / S-adenosyl-L-methionine binding / nucleosomal DNA binding / muscle organ development / histone methyltransferase activity / positive regulation of double-strand break repair via nonhomologous end joining / RNA polymerase II core promoter sequence-specific DNA binding / heterochromatin / intercellular bridge / cellular response to estradiol stimulus / euchromatin / PKMTs methylate histone lysines / chromatin DNA binding / cytoplasmic ribonucleoprotein granule / fibrillar center / mitotic spindle / structural constituent of chromatin / nucleosome / heterochromatin formation / nucleosome assembly / chromatin organization / microtubule cytoskeleton / methylation / ciliary basal body / cilium / RNA polymerase II cis-regulatory region sequence-specific DNA binding / Amyloid fiber formation / protein heterodimerization activity / DNA repair / centrosome / chromatin binding / nucleolus / positive regulation of transcription by RNA polymerase II / DNA binding / extracellular exosome / nucleoplasm / metal ion binding / nucleus / plasma membrane 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.6 Å | |||||||||||||||
 データ登録者 データ登録者 | Abini-Agbomson S / Armache K-J | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2023 ジャーナル: Mol Cell / 年: 2023タイトル: Catalytic and non-catalytic mechanisms of histone H4 lysine 20 methyltransferase SUV420H1. 著者: Stephen Abini-Agbomson / Kristjan Gretarsson / Rochelle M Shih / Laura Hsieh / Tracy Lou / Pablo De Ioannes / Nikita Vasilyev / Rachel Lee / Miao Wang / Matthew D Simon / Jean-Paul Armache / ...著者: Stephen Abini-Agbomson / Kristjan Gretarsson / Rochelle M Shih / Laura Hsieh / Tracy Lou / Pablo De Ioannes / Nikita Vasilyev / Rachel Lee / Miao Wang / Matthew D Simon / Jean-Paul Armache / Evgeny Nudler / Geeta Narlikar / Shixin Liu / Chao Lu / Karim-Jean Armache /  要旨: SUV420H1 di- and tri-methylates histone H4 lysine 20 (H4K20me2/H4K20me3) and plays crucial roles in DNA replication, repair, and heterochromatin formation. It is dysregulated in several cancers. Many ...SUV420H1 di- and tri-methylates histone H4 lysine 20 (H4K20me2/H4K20me3) and plays crucial roles in DNA replication, repair, and heterochromatin formation. It is dysregulated in several cancers. Many of these processes were linked to its catalytic activity. However, deletion and inhibition of SUV420H1 have shown distinct phenotypes, suggesting that the enzyme likely has uncharacterized non-catalytic activities. Our cryoelectron microscopy (cryo-EM), biochemical, biophysical, and cellular analyses reveal how SUV420H1 recognizes its nucleosome substrates, and how histone variant H2A.Z stimulates its catalytic activity. SUV420H1 binding to nucleosomes causes a dramatic detachment of nucleosomal DNA from the histone octamer, which is a non-catalytic activity. We hypothesize that this regulates the accessibility of large macromolecular complexes to chromatin. We show that SUV420H1 can promote chromatin condensation, another non-catalytic activity that we speculate is needed for its heterochromatin functions. Together, our studies uncover and characterize the catalytic and non-catalytic mechanisms of SUV420H1, a key histone methyltransferase that plays an essential role in genomic stability. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_41109.map.gz emd_41109.map.gz | 32.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-41109-v30.xml emd-41109-v30.xml emd-41109.xml emd-41109.xml | 26.6 KB 26.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_41109.png emd_41109.png | 67 KB | ||
| Filedesc metadata |  emd-41109.cif.gz emd-41109.cif.gz | 7.4 KB | ||
| その他 |  emd_41109_half_map_1.map.gz emd_41109_half_map_1.map.gz emd_41109_half_map_2.map.gz emd_41109_half_map_2.map.gz | 116.1 MB 116.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-41109 http://ftp.pdbj.org/pub/emdb/structures/EMD-41109 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41109 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-41109 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_41109_validation.pdf.gz emd_41109_validation.pdf.gz | 729.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_41109_full_validation.pdf.gz emd_41109_full_validation.pdf.gz | 729 KB | 表示 | |
| XML形式データ |  emd_41109_validation.xml.gz emd_41109_validation.xml.gz | 13.9 KB | 表示 | |
| CIF形式データ |  emd_41109_validation.cif.gz emd_41109_validation.cif.gz | 16.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41109 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41109 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41109 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-41109 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8t9fMC  8t9hC  8thuC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_41109.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_41109.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 3D reconstruction SUV420H1-H2A.Z nucleosome complex | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.079 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map from the 3D reconstruction SUV420H1-H2A.Z nucleosome complex
| ファイル | emd_41109_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map from the 3D reconstruction SUV420H1-H2A.Z nucleosome complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map from the 3D reconstruction SUV420H1-H2A.Z nucleosome complex
| ファイル | emd_41109_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map from the 3D reconstruction SUV420H1-H2A.Z nucleosome complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : SUV420H1-H2A.Z nucleosome complex
| 全体 | 名称: SUV420H1-H2A.Z nucleosome complex |
|---|---|
| 要素 |
|
-超分子 #1: SUV420H1-H2A.Z nucleosome complex
| 超分子 | 名称: SUV420H1-H2A.Z nucleosome complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#5, #7, #6 |
|---|---|
| 由来(天然) | 生物種: |
-分子 #1: Histone-lysine N-methyltransferase KMT5B
| 分子 | 名称: Histone-lysine N-methyltransferase KMT5B / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO EC番号: [histone H4]-N-methyl-L-lysine20 N-methyltransferase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 44.69016 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKWLGESKNM VVNGRRNGGK LSNDHQQNQS KLQHTGKDTL KAGKNAVERR SNRCNGNSGF EGQSRYVPSS GMSAKELCEN DDLATSLVL DPYLGFQTHK MNTSAFPSRS SRHFSKSDSF SHNNPVRFRP IKGRQEELKE VIERFKKDEH LEKAFKCLTS G EWARHYFL ...文字列: MKWLGESKNM VVNGRRNGGK LSNDHQQNQS KLQHTGKDTL KAGKNAVERR SNRCNGNSGF EGQSRYVPSS GMSAKELCEN DDLATSLVL DPYLGFQTHK MNTSAFPSRS SRHFSKSDSF SHNNPVRFRP IKGRQEELKE VIERFKKDEH LEKAFKCLTS G EWARHYFL NKNKMQEKLF KEHVFIYLRM FATDSGFEIL PCNRYSSEQN GAKIVATKEW KRNDKIELLV GCIAELSEIE EN MLLRHGE NDFSVMYSTR KNCAQLWLGP AAFINHDCRP NCKFVSTGRD TACVKALRDI EPGEEISCYY GDGFFGENNE FCE CYTCER RGTGAFKSRV GLPAPAPVIN SKYGLRETDK RLNRLKKLGD SSKNSDSQSV SSNTDADTTQ EKNNASK UniProtKB: Histone-lysine N-methyltransferase KMT5B |
-分子 #4: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 11.396442 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSGRGKGGKG LGKGGAKRHR MVLRDNIQGI TKPAIRRLAR RGGVKRISGL IYEETRGVLK VFLENVIRDA VTYTEHAKRK TVTAMDVVY ALKRQGRTLY GFGG UniProtKB: Histone H4 |
-分子 #5: Histone H3.2
| 分子 | 名称: Histone H3.2 / タイプ: protein_or_peptide / ID: 5 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 15.30393 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: ARTKQTARKS TGGKAPRKQL ATKAARKSAP ATGGVKKPHR YRPGTVALRE IRRYQKSTEL LIRKLPFQRL VREIAQDFKT DLRFQSSAV MALQEASEAY LVALFEDTNL CAIHAKRVTI MPKDIQLARR IRGERA UniProtKB: Histone H3.2 |
-分子 #6: Histone H2A.Z
| 分子 | 名称: Histone H2A.Z / タイプ: protein_or_peptide / ID: 6 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 13.581796 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAGGKAGKDS GKAKTKAVSR SQRAGLQFPV GRIHRHLKSR TTSHGRVGAT AAVYSAAILE YLTAEVLELA GNASKDLKVK RITPRHLQL AIRGDEELDS LIKATIAGGG VIPHIHKSLI GKKGQQKTV UniProtKB: Histone H2A.Z |
-分子 #7: Histone H2B 1.1
| 分子 | 名称: Histone H2B 1.1 / タイプ: protein_or_peptide / ID: 7 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 13.655948 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAKSAPAPKK GSKKAVTKTQ KKDGKKRRKT RKESYAIYVY KVLKQVHPDT GISSKAMSIM NSFVNDVFER IAGEASRLAH YNKRSTITS REIQTAVRLL LPGELAKHAV SEGTKAVTKY TSAK UniProtKB: Histone H2B 1.1 |
-分子 #2: DNA (122-MER)
| 分子 | 名称: DNA (122-MER) / タイプ: dna / ID: 2 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 44.82457 KDa |
| 配列 | 文字列: (DT)(DC)(DG)(DA)(DG)(DA)(DA)(DT)(DC)(DC) (DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA)(DG) (DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA)(DA) (DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA)(DG) (DA) (DC)(DA)(DG)(DC)(DT) ...文字列: (DT)(DC)(DG)(DA)(DG)(DA)(DA)(DT)(DC)(DC) (DC)(DG)(DG)(DT)(DG)(DC)(DC)(DG)(DA)(DG) (DG)(DC)(DC)(DG)(DC)(DT)(DC)(DA)(DA) (DT)(DT)(DG)(DG)(DT)(DC)(DG)(DT)(DA)(DG) (DA) (DC)(DA)(DG)(DC)(DT)(DC)(DT)(DA) (DG)(DC)(DA)(DC)(DC)(DG)(DC)(DT)(DT)(DA) (DA)(DA) (DC)(DG)(DC)(DA)(DC)(DG)(DT) (DA)(DC)(DG)(DG)(DA)(DT)(DT)(DC)(DT)(DC) (DC)(DC)(DC) (DC)(DG)(DC)(DG)(DT)(DT) (DT)(DT)(DA)(DA)(DC)(DC)(DG)(DC)(DC)(DA) (DA)(DG)(DG)(DG) (DG)(DA)(DT)(DT)(DA) (DC)(DT)(DC)(DC)(DC)(DT)(DA)(DG)(DT)(DC) (DT)(DC)(DC)(DA)(DG) (DG)(DC)(DA)(DC) (DG)(DT)(DG)(DT)(DC)(DA)(DG)(DA)(DT)(DA) (DT)(DA)(DT)(DA)(DC)(DA) (DT)(DC)(DC) (DG)(DA)(DT) |
-分子 #3: DNA (122-MER)
| 分子 | 名称: DNA (122-MER) / タイプ: dna / ID: 3 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 45.304863 KDa |
| 配列 | 文字列: (DA)(DT)(DC)(DG)(DG)(DA)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC) (DA)(DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG) (DG)(DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG) (DA) (DG)(DT)(DA)(DA)(DT) ...文字列: (DA)(DT)(DC)(DG)(DG)(DA)(DT)(DG)(DT)(DA) (DT)(DA)(DT)(DA)(DT)(DC)(DT)(DG)(DA)(DC) (DA)(DC)(DG)(DT)(DG)(DC)(DC)(DT)(DG) (DG)(DA)(DG)(DA)(DC)(DT)(DA)(DG)(DG)(DG) (DA) (DG)(DT)(DA)(DA)(DT)(DC)(DC)(DC) (DC)(DT)(DT)(DG)(DG)(DC)(DG)(DG)(DT)(DT) (DA)(DA) (DA)(DA)(DC)(DG)(DC)(DG)(DG) (DG)(DG)(DG)(DA)(DG)(DA)(DA)(DT)(DC)(DC) (DG)(DT)(DA) (DC)(DG)(DT)(DG)(DC)(DG) (DT)(DT)(DT)(DA)(DA)(DG)(DC)(DG)(DG)(DT) (DG)(DC)(DT)(DA) (DG)(DA)(DG)(DC)(DT) (DG)(DT)(DC)(DT)(DA)(DC)(DG)(DA)(DC)(DC) (DA)(DA)(DT)(DT)(DG) (DA)(DG)(DC)(DG) (DG)(DC)(DC)(DT)(DC)(DG)(DG)(DC)(DA)(DC) (DC)(DG)(DG)(DG)(DA)(DT) (DT)(DC)(DT) (DC)(DG)(DA) |
-分子 #8: S-ADENOSYLMETHIONINE
| 分子 | 名称: S-ADENOSYLMETHIONINE / タイプ: ligand / ID: 8 / コピー数: 1 / 式: SAM |
|---|---|
| 分子量 | 理論値: 398.437 Da |
| Chemical component information | 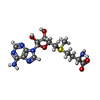 ChemComp-SAM: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.9 構成要素:
詳細: 50 mM HEPES pH 7.9, 100 mM NaCl, 2 mM DTT | ||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)