+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 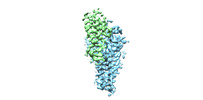 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of human ZDHHC9/GCP16 complex | |||||||||
 マップデータ マップデータ | the refined map of human DHHC9/GCP16 complex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | plamitoytransferase / palmitoylation / DHHC / RAS / TRANSFERASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報palmitoyltransferase complex / Ras palmitoyltransferase activity / peptidyl-L-cysteine S-palmitoylation / protein S-acyltransferase / protein palmitoylation / protein-cysteine S-palmitoyltransferase activity / palmitoyltransferase activity / Golgi to plasma membrane transport / Golgi to plasma membrane protein transport / Golgi stack ...palmitoyltransferase complex / Ras palmitoyltransferase activity / peptidyl-L-cysteine S-palmitoylation / protein S-acyltransferase / protein palmitoylation / protein-cysteine S-palmitoyltransferase activity / palmitoyltransferase activity / Golgi to plasma membrane transport / Golgi to plasma membrane protein transport / Golgi stack / positive regulation by host of viral process / protein targeting to membrane / endoplasmic reticulum-Golgi intermediate compartment membrane / RAS processing / MAPK cascade / tertiary granule lumen / Maturation of spike protein / protein stabilization / Golgi membrane / Neutrophil degranulation / endoplasmic reticulum membrane / Golgi apparatus / endoplasmic reticulum / extracellular exosome / extracellular region / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Wu J / Hu Q / Zhang Y / Liu S / Yang A | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Struct Mol Biol / 年: 2024 ジャーナル: Nat Struct Mol Biol / 年: 2024タイトル: Regulation of RAS palmitoyltransferases by accessory proteins and palmitoylation. 著者: Anlan Yang / Shengjie Liu / Yuqi Zhang / Jia Chen / Yujing Fan / Fengxiang Wang / Yilong Zou / Shan Feng / Jianping Wu / Qi Hu /  要旨: Palmitoylation of cysteine residues at the C-terminal hypervariable regions in human HRAS and NRAS, which is necessary for RAS signaling, is catalyzed by the acyltransferase DHHC9 in complex with its ...Palmitoylation of cysteine residues at the C-terminal hypervariable regions in human HRAS and NRAS, which is necessary for RAS signaling, is catalyzed by the acyltransferase DHHC9 in complex with its accessory protein GCP16. The molecular basis for the acyltransferase activity and the regulation of DHHC9 by GCP16 is not clear. Here we report the cryo-electron microscopy structures of the human DHHC9-GCP16 complex and its yeast counterpart-the Erf2-Erf4 complex, demonstrating that GCP16 and Erf4 are not directly involved in the catalytic process but stabilize the architecture of DHHC9 and Erf2, respectively. We found that a phospholipid binding to an arginine-rich region of DHHC9 and palmitoylation on three residues (C24, C25 and C288) were essential for the catalytic activity of the DHHC9-GCP16 complex. Moreover, we showed that GCP16 also formed complexes with DHHC14 and DHHC18 to catalyze RAS palmitoylation. These findings provide insights into the regulatory mechanism of RAS palmitoyltransferases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34711.map.gz emd_34711.map.gz | 59.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34711-v30.xml emd-34711-v30.xml emd-34711.xml emd-34711.xml | 15.9 KB 15.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_34711.png emd_34711.png | 26.2 KB | ||
| Filedesc metadata |  emd-34711.cif.gz emd-34711.cif.gz | 5.6 KB | ||
| その他 |  emd_34711_half_map_1.map.gz emd_34711_half_map_1.map.gz emd_34711_half_map_2.map.gz emd_34711_half_map_2.map.gz | 59.2 MB 59.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34711 http://ftp.pdbj.org/pub/emdb/structures/EMD-34711 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34711 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34711 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_34711_validation.pdf.gz emd_34711_validation.pdf.gz | 707.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_34711_full_validation.pdf.gz emd_34711_full_validation.pdf.gz | 707.3 KB | 表示 | |
| XML形式データ |  emd_34711_validation.xml.gz emd_34711_validation.xml.gz | 12.3 KB | 表示 | |
| CIF形式データ |  emd_34711_validation.cif.gz emd_34711_validation.cif.gz | 14.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34711 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34711 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34711 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34711 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8hf3MC  8hfcC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34711.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34711.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | the refined map of human DHHC9/GCP16 complex | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.8389 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: the half A map of human DHHC9/GCP16 complex
| ファイル | emd_34711_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | the half A map of human DHHC9/GCP16 complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: the half B map of human DHHC9/GCP16 complex
| ファイル | emd_34711_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | the half B map of human DHHC9/GCP16 complex | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human ZDHHC9/GCP16 complex
| 全体 | 名称: Human ZDHHC9/GCP16 complex |
|---|---|
| 要素 |
|
-超分子 #1: Human ZDHHC9/GCP16 complex
| 超分子 | 名称: Human ZDHHC9/GCP16 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Palmitoyltransferase ZDHHC9
| 分子 | 名称: Palmitoyltransferase ZDHHC9 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: protein S-acyltransferase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 41.954457 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MSVMVVRKKV TRKWEKLPGR NTFCCDGRVM MARQKGIFYL TLFLILGTCT LFFAFECRYL AVQLSPAIPV FAAMLFLFSM ATLLRTSFS DPGVIPRALP DEAAFIEMEI EATNGAVPQG QRPPPRIKNF QINNQIVKLK YCYTCKIFRP PRASHCSICD N CVERFDHH ...文字列: MSVMVVRKKV TRKWEKLPGR NTFCCDGRVM MARQKGIFYL TLFLILGTCT LFFAFECRYL AVQLSPAIPV FAAMLFLFSM ATLLRTSFS DPGVIPRALP DEAAFIEMEI EATNGAVPQG QRPPPRIKNF QINNQIVKLK YCYTCKIFRP PRASHCSICD N CVERFDHH CPWVGNCVGK RNYRYFYLFI LSLSLLTIYV FAFNIVYVAL KSLKIGFLET LKETPGTVLE VLICFFTLWS VV GLTGFHT FLVALNQTTN EDIKGSWTGK NRVQNPYSHG NIVKNCCEVL CGPLPPSVLD RRGILPLEES GSRPPSTQET SSS LLPQSP APTEHLNSNE MPEDSSTPEE MPPPEPPEPP QEAAEAEKDY KDDDDK UniProtKB: Palmitoyltransferase ZDHHC9 |
-分子 #2: Golgin subfamily A member 7
| 分子 | 名称: Golgin subfamily A member 7 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 16.803133 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MHHHHHHMRP QQAPVSGKVF IQRDYSSGTR CQFQTKFPAE LENRIDRQQF EETVRTLNNL YAEAEKLGGQ SYLEGCLACL TAYTIFLCM ETHYEKVLKK VSKYIQEQNE KIYAPQGLLL TDPIERGLRV IEITIYEDRG MSSGR UniProtKB: Golgin subfamily A member 7 |
-分子 #3: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #4: PALMITIC ACID
| 分子 | 名称: PALMITIC ACID / タイプ: ligand / ID: 4 / コピー数: 4 / 式: PLM |
|---|---|
| 分子量 | 理論値: 256.424 Da |
| Chemical component information |  ChemComp-PLM: |
-分子 #5: 1,2-DILAUROYL-SN-GLYCERO-3-PHOSPHATE
| 分子 | 名称: 1,2-DILAUROYL-SN-GLYCERO-3-PHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 1 / 式: PX2 |
|---|---|
| 分子量 | 理論値: 535.671 Da |
| Chemical component information |  ChemComp-PX2: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 236435 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー



 Z
Z Y
Y X
X