+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of the N-terminal domain of hMCM8/9 and HROB | |||||||||
 マップデータ マップデータ | complex of human MCM8/9 NTD and HROB | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | MCM8/9 / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報MutLbeta complex binding / MutSbeta complex binding / recombinational interstrand cross-link repair / MCM8-MCM9 complex / male gamete generation / mismatch repair involved in maintenance of fidelity involved in DNA-dependent DNA replication / CDC6 association with the ORC:origin complex / MutSalpha complex binding / E2F-enabled inhibition of pre-replication complex formation / female gamete generation ...MutLbeta complex binding / MutSbeta complex binding / recombinational interstrand cross-link repair / MCM8-MCM9 complex / male gamete generation / mismatch repair involved in maintenance of fidelity involved in DNA-dependent DNA replication / CDC6 association with the ORC:origin complex / MutSalpha complex binding / E2F-enabled inhibition of pre-replication complex formation / female gamete generation / Unwinding of DNA / MCM complex / DNA duplex unwinding / single-stranded DNA helicase activity / Activation of the pre-replicative complex / Activation of ATR in response to replication stress / DNA helicase activity / protein localization to chromatin / double-strand break repair via homologous recombination / Orc1 removal from chromatin / chromosome / single-stranded DNA binding / DNA helicase / protein stabilization / cell cycle / DNA damage response / chromatin binding / protein-containing complex binding / enzyme binding / ATP hydrolysis activity / nucleoplasm / ATP binding / nucleus 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.95 Å | |||||||||
 データ登録者 データ登録者 | Zheng JF / Weng ZF / Liu YF | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2023 ジャーナル: Elife / 年: 2023タイトル: Structural and mechanistic insights into the MCM8/9 helicase complex. 著者: Zhuangfeng Weng / Jiefu Zheng / Yiyi Zhou / Zuer Lu / Yixi Wu / Dongyi Xu / Huanhuan Li / Huanhuan Liang / Yingfang Liu /  要旨: MCM8 and MCM9 form a functional helicase complex (MCM8/9) that plays an essential role in DNA homologous recombination repair for DNA double-strand break. However, the structural characterization of ...MCM8 and MCM9 form a functional helicase complex (MCM8/9) that plays an essential role in DNA homologous recombination repair for DNA double-strand break. However, the structural characterization of MCM8/9 for DNA binding/unwinding remains unclear. Here, we report structures of the MCM8/9 complex using cryo-electron microscopy single particle analysis. The structures reveal that MCM8/9 is arranged into a heterohexamer through a threefold symmetry axis, creating a central channel that accommodates DNA. Multiple characteristic hairpins from the N-terminal oligosaccharide/oligonucleotide (OB) domains of MCM8/9 protrude into the central channel and serve to unwind the duplex DNA. When activated by HROB, the structure of MCM8/9's N-tier ring converts its symmetry from to with a conformational change that expands the MCM8/9's trimer interface. Moreover, our structural dynamic analyses revealed that the flexible C-tier ring exhibited rotary motions relative to the N-tier ring, which is required for the unwinding ability of MCM8/9. In summary, our structural and biochemistry study provides a basis for understanding the DNA unwinding mechanism of MCM8/9 helicase in homologous recombination. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_33989.map.gz emd_33989.map.gz | 59.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-33989-v30.xml emd-33989-v30.xml emd-33989.xml emd-33989.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_33989.png emd_33989.png | 71.1 KB | ||
| Filedesc metadata |  emd-33989.cif.gz emd-33989.cif.gz | 5.4 KB | ||
| その他 |  emd_33989_half_map_1.map.gz emd_33989_half_map_1.map.gz emd_33989_half_map_2.map.gz emd_33989_half_map_2.map.gz | 59.5 MB 59.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-33989 http://ftp.pdbj.org/pub/emdb/structures/EMD-33989 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33989 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-33989 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_33989_validation.pdf.gz emd_33989_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_33989_full_validation.pdf.gz emd_33989_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_33989_validation.xml.gz emd_33989_validation.xml.gz | 12.2 KB | 表示 | |
| CIF形式データ |  emd_33989_validation.cif.gz emd_33989_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33989 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33989 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33989 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-33989 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7yoxMC  7w7pC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_33989.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_33989.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | complex of human MCM8/9 NTD and HROB | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.827 Å | ||||||||||||||||||||
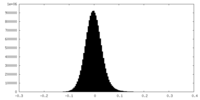
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: half map A
| ファイル | emd_33989_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
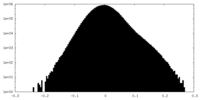
| 密度ヒストグラム |
-ハーフマップ: half map B
| ファイル | emd_33989_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
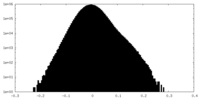
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Minichromosome maintenance 8 and 9
| 全体 | 名称: Minichromosome maintenance 8 and 9 |
|---|---|
| 要素 |
|
-超分子 #1: Minichromosome maintenance 8 and 9
| 超分子 | 名称: Minichromosome maintenance 8 and 9 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: DNA helicase MCM8
| 分子 | 名称: DNA helicase MCM8 / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO / EC番号: DNA helicase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 35.482418 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: TPQSMQSTLD RFIPYKGWKL YFSEVYSDSS PLIEKIQAFE KFFTRHIDLY DKDEIERKGS ILVDFKELTE GGEVTNLIPD IATELRDAP EKTLACMGLA IHQVLTKDLE RHAAELQAQE GLSNDGETMV NVPHIHARVY NYEPLTQLKN VRANYYGKYI A LRGTVVRV ...文字列: TPQSMQSTLD RFIPYKGWKL YFSEVYSDSS PLIEKIQAFE KFFTRHIDLY DKDEIERKGS ILVDFKELTE GGEVTNLIPD IATELRDAP EKTLACMGLA IHQVLTKDLE RHAAELQAQE GLSNDGETMV NVPHIHARVY NYEPLTQLKN VRANYYGKYI A LRGTVVRV SNIKPLCTKM AFLCAACGEI QSFPLPDGKY SLPTKCPVPV CRGRSFTALR SSPLTVTMDW QSIKIQELMS DD QREAGRI PRTIECELVH DLVDSCVPGD TVTITGIVKV SNAEEGSRNK NDKCMFLLYI EANSISNSKG QKTKSSEDG UniProtKB: DNA helicase MCM8 |
-分子 #2: DNA helicase MCM9
| 分子 | 名称: DNA helicase MCM9 / タイプ: protein_or_peptide / ID: 2 / コピー数: 3 / 光学異性体: LEVO / EC番号: DNA helicase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 31.572082 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MNSDQVTLVG QVFESYVSEY HKNDILLILK ERDEDAHYPV VVNAMTLFET NMEIGEYFNM FPSEVLTIFD SALRRSALTI LQSLSQPEA VSMKQNLHAR ISGLPVCPEL VREHIPKTKD VGHFLSVTGT VIRTSLVKVL EFERDYMCNK CKHVFVIKAD F EQYYTFCR ...文字列: MNSDQVTLVG QVFESYVSEY HKNDILLILK ERDEDAHYPV VVNAMTLFET NMEIGEYFNM FPSEVLTIFD SALRRSALTI LQSLSQPEA VSMKQNLHAR ISGLPVCPEL VREHIPKTKD VGHFLSVTGT VIRTSLVKVL EFERDYMCNK CKHVFVIKAD F EQYYTFCR PSSCPSLESC DSSKFTCLSG LSSSPTRCRD YQEIKIQEQV QRLSVGSIPR SMKVILEDDL VDSCKSGDDL TI YGIVMQR WKPFQQDVRC EVEIVLKANY IQVNNEQSS UniProtKB: DNA helicase MCM9 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| グリッド | 材質: COPPER |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: 詳細: 7DP3 and 7DPD |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.95 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 95257 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION |
| 最終 角度割当 | タイプ: ANGULAR RECONSTITUTION |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-7yox: |
 ムービー
ムービー コントローラー
コントローラー








 Z
Z Y
Y X
X