登録情報 データベース : EMDB / ID : EMD-29684タイトル Cryo-EM structure of ADGRF1 coupled to miniGs/q 複合体 : Tethered agonist activated adhesion GPCR ADGRF1 coupled to miniGs/qタンパク質・ペプチド : MiniG alpha s/q chimeraタンパク質・ペプチド : Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1タンパク質・ペプチド : Guanine nucleotide-binding protein G(I)/G(S)/G(O) subunit gamma-2タンパク質・ペプチド : Nanobody 35タンパク質・ペプチド : Adhesion G-protein-coupled receptor F1リガンド : [1-MYRISTOYL-GLYCEROL-3-YL]PHOSPHONYLCHOLINE機能・相同性 分子機能 ドメイン・相同性 構成要素
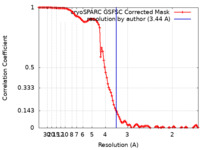
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト) / Lama glama (ラマ)手法 / / 解像度 : 3.44 Å Jones D / Rawson S / Blacklow S 資金援助 Organization Grant number 国 National Institutes of Health/National Cancer Institute (NIH/NCI) 1R35 CA220340
ジャーナル : Nat Commun / 年 : 2023タイトル : Tethered agonist activated ADGRF1 structure and signalling analysis reveal basis for G protein coupling.著者 : Daniel T D Jones / Andrew N Dates / Shaun D Rawson / Maggie M Burruss / Colin H Lipper / Stephen C Blacklow / 要旨 : Adhesion G Protein Coupled Receptors (aGPCRs) have evolved an activation mechanism to translate extracellular force into liberation of a tethered agonist (TA) to effect cell signalling. We report ... Adhesion G Protein Coupled Receptors (aGPCRs) have evolved an activation mechanism to translate extracellular force into liberation of a tethered agonist (TA) to effect cell signalling. We report here that ADGRF1 can signal through all major G protein classes and identify the structural basis for a previously reported Gα preference by cryo-EM. Our structure shows that Gα preference in ADGRF1 may derive from tighter packing at the conserved F569 of the TA, altering contacts between TM helix I and VII, with a concurrent rearrangement of TM helix VII and helix VIII at the site of Gα recruitment. Mutational studies of the interface and of contact residues within the 7TM domain identify residues critical for signalling, and suggest that Gα signalling is more sensitive to mutation of TA or binding site residues than Gα. Our work advances the detailed molecular understanding of aGPCR TA activation, identifying features that potentially explain preferential signal modulation. 履歴 登録 2023年2月6日 - ヘッダ(付随情報) 公開 2023年5月10日 - マップ公開 2023年5月10日 - 更新 2023年5月10日 - 現状 2023年5月10日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト) /
Homo sapiens (ヒト) / 
 データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Nat Commun / 年: 2023
ジャーナル: Nat Commun / 年: 2023
 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_29684.map.gz
emd_29684.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-29684-v30.xml
emd-29684-v30.xml emd-29684.xml
emd-29684.xml EMDBヘッダ
EMDBヘッダ emd_29684_fsc.xml
emd_29684_fsc.xml FSCデータファイル
FSCデータファイル emd_29684.png
emd_29684.png emd_29684_additional_1.map.gz
emd_29684_additional_1.map.gz emd_29684_additional_2.map.gz
emd_29684_additional_2.map.gz emd_29684_half_map_1.map.gz
emd_29684_half_map_1.map.gz emd_29684_half_map_2.map.gz
emd_29684_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-29684
http://ftp.pdbj.org/pub/emdb/structures/EMD-29684 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29684
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29684 emd_29684_validation.pdf.gz
emd_29684_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_29684_full_validation.pdf.gz
emd_29684_full_validation.pdf.gz emd_29684_validation.xml.gz
emd_29684_validation.xml.gz emd_29684_validation.cif.gz
emd_29684_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29684
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29684 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29684
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29684
 F&H 検索
F&H 検索 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_29684.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_29684.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)

 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー





















 Z
Z Y
Y X
X